|
La titulación o valoración es un método de laboratorio común en análisis químico cuantitativo usado para determinar la concentración de un sustrato o analito. Las medidas de volumen juegan un papel importante en la titulación o valoración, por eso se llama también análisis volumétrico.[1] Conocimientos adicionales recomendados¿En qué consiste una valoración?Un reactivo de concentración y volumen conocidos (una disolución estándar) o patrón se usa para reaccionar con la sustancia a analizar, cuya concentración no es conocida de antemano. Se usa una bureta calibrada para añadir la disolución titulante, siendo así posible determinar la cantidad exacta que se ha consumido cuando se alcanza el punto final o punto de equivalencia. El punto final es el punto en el que la titulación o valoración está completa, y suele determinarse mediante un indicador (ver debajo). Este tiene idealmente el mismo volumen que el punto de equivalencia - el volumen de disolución estándar añadido para el cual el número de equivalentes de la sustancia tituladora es igual al número de equivalentes de la sustancia a analizar (analito). En una valoración ácido fuerte-base fuerte, el punto final de la titulación o valoración es el punto en el que el pH de la mezcla es justamente igual a 7, y a menudo coincide con un cambio de color de la disolución debido a un indicador de pH. Hay muchos tipos diferentes de titulaciones o valoraciones. Pueden usarse muchos métodos para indicar el punto final de una reacción: a menudo se usan indicadores visuales (cambian de color). En una titulación o valoración ácido-base simple, puede usarse un indicador de pH, como la fenolftaleína, que es normalmente incolora pero adquiere color rosa cuando el pH es igual o mayor que 8,2. Otro ejemplo es el naranja de metilo, de color rojo con los ácidos y amarillo en disoluciones básicas. No todas las titulaciones requieren un indicador. En algunos casos, o bien los reactivos o los productos tienen colores fuertes y pueden servir como "indicador". Por ejemplo, una titulación o valoración redox que usa permanganato de potasio como disolución estándar (rosa/violeta) no requiere indicador porque sufre un cambio de color fácil de detectar pues queda incolora al reducirse. Después del punto de equivalencia, hay exceso de la disolución titulante y persiste un color rosado débil que no pierde el color. Debido a la naturaleza logarítmica de la curva de pH, las transiciones en el punto final son muy rápidas; y entonces, una simple gota puede cambiar el pH de modo muy significativo y provocar un cambio de color en el indicador. Hay una ligera diferencia entre el cambio de color del indicador y el punto de equivalencia de la titulación o valoración. Este error se llama error de indicador, y es indeterminado. Historia y etimologíaLa palabra "titulación" viene del Latín titalus, que significa inscripción o título. La palabra francesa titre, del mismo origen, significa rango o grado. Una titulación o valoración es, por definición, la determinación del grado o concentración de una disolución. Los origenes del análisis volumétrico están en Francia en la química de finales del siglo XVII. François Antoine Henri Descroizilles desarrolló la primera bureta (con aspecto de un cilindro graduado) en 1791. Joseph Louis Gay-Lussac desarrolló una versión mejorada de la bureta que incluía un brazo lateral, y acuñó los términos "pipeta" y "bureta" en un artículo de 1824 sobre la estandarización de disoluciones de índigo. Un gran paso adelante en la metodología y popularización del análisis volumétrico se debe a Karl Friedrich Mohr, que rediseñó la bureta colocando un cierre con pinza y una cánula de vertido en el extremo inferior, y escribió el primer libro sobre su uso, Lehrbuch der chemisch-analytischen Titrirmethode (Manual sobre métodos de titulación en Química Analítica), publicado en 1855.[2] Preparación de una muestra para titulación o valoraciónEn un titulación o valoración, la sustancia patrón y el analito deben estar en fase acuosa, en disolución. Si la muestra no es un líquido o una disolución, debe ser disuelta. Si el analito está muy concentrado en la muestra a analizar, suele diluirse. Aunque la amplia mayoría de titulaciones se llevan a cabo en disolución acuosa, pueden usarse otros disolventes como ácido acético o etanol con igual finalidad. Una cantidad medida de muestra se coloca en un frasco donde se disuelve y se diluye si es necesario. La cantidad de disolvente usado para disolver o diluir debe ser bien conocida (generalmente es un coeficiente entero) para poder considerarlo en el resultado matemático de la valoración de la muestra original. Muchas valoraciones requieren un cierto control del pH de la reacción. Para ello, se usan disoluciones amortiguadoras añadidas a la disolución a analizar. En otros casos se debe enmascarar un cierto ión: esto es necesario cuando hay dos reactivos en la muestra que pueden reaccionar con la sustancia patrón y solo queremos valorar uno de ellos, o bien cuando la reacción puede ser inhibida o alterada por la presencia de ese ión. Se procede añadiendo otra disolución a la muestra para enmascarar o secuestrar el ión no deseado, mediante la formación de un enlace débil con él o incluso formando una sustancia insoluble. Algunas reacciones redox pueden requerir calentar la disolución con la muestra y valorar mientras está todavía caliente (para incrementar la velocidad de reacción). ProcedimientoUna titulación o valoración comienza con un vaso de precipitados o matraz Erlenmeyer conteniendo un volumen preciso del reactivo a analizar y una pequeña cantidad de indicador, colocado debajo de una bureta que contiene la disolución estándar. Controlando cuidadosamente la cantidad añadida, es posible detectar el punto en el que el indicador cambia de color. Si el indicador ha sido elegido correctamente, este debería ser también el punto de neutralización de los dos reactivos. Leyendo en la escala de la bureta sabremos con precisión el volumen de disolución añadida. Como la concentración de la disolución estándar y el volumen añadido son conocidos, podemos calcular el número de moles de esa sustancia (ya que concentración = moles / volumen). Luego, a partir de la ecuación química que representa el proceso que tiene lugar, podremos calcular el número de moles de la sustancia a analizar presentes en la muestra. Finalmente, dividiendo el número de moles de reactivo por su volumen, conoceremos la concentración buscada. Curvas de valoraciónLas valoraciones se representan mediante curvas de valoración, en las que suele representarse como variable independiente el volumen añadido de disolución estándar, titulante o patrón, mientras la variable dependiente es el pH de la disolución (que cambia según la composición de las dos disoluciones). El punto de equivalencia es un punto significativo en la gráfica (el punto en el que toda la disolución inicial, usualmente un ácido, ha sido neutralizado por la disolución que se usa como referencia,que suele ser una base). Puede calcularse con precisión a partir de la segunda derivada de la curva de valoración encontrando los puntos de inflexión (donde la gráfica cambia de concavidad); sin embargo, en la mayoría de los casos, bastará una simple inspección visual de la curva. En la curva de la imagen de la derecha, ambos puntos de equivalencia son visibles, después de añadir aproximadamente 15 y 30 mL de disolución de hidróxido sódico se ha valorado la disolución de ácido oxálico. Para calcular los valores de pKa (constantes de acidez), debemos encontrar el volumen para el punto de semi-equivalencia , es decir cuando se ha añadido la mitad de la cantidad de sustancia titulante necesaria para formar el compuesto (aquí, oxalato monosódico, y luego oxalato disódico). Estas cantidades que son la mitad del punto de equivalencia son 7.5 mL y 22.5 mL, y los valores de pH observado son aproximadamente 1,5 y 4,0; y nos dan los valores de pKa para ese ácido. Para ácidos monopróticos, el punto a mitad de camino entre el comienzo de la curva (antes de empezar a añadir la disolución estándar) y el punto de equivalencia es significativo: en ese punto, las concentraciones de las dos especies (el ácido y la base conjugada) son iguales. Por tanto, permite resolver la ecuación de Henderson-Hasselbalch de esta manera: Las definiciones de estas variables son: Podemos pues encontrar con facilidad la constante de disociación del ácido monoprótico encontrando el pH del punto a mitad de camino entre el comienzo de la curva y el punto de equivalencia, y resolviendo la ecuación simplificada. En el caso de una curva de ejemplo, con un pH en el punto de semiequivalencia de 4,75. Eso nos daría un Ka que sería aproximadamente:
Tipos de titulación o valoraciónLas valoraciones se clasifican por el tipo de objeto a analizar:
NaX(ac) + AgNO3(ac) → AgX(s) + NaNO3(ac) donde X = F-, Cl-, Br-, I-, SCN- Medida del punto final de una titulación o valoraciónHay diferentes métodos para determinar el punto final o punto de equivalencia:
Valoración por retroceso o inversaEl método de valoración por retroceso se usa cuando se invierte el sentido de la valoración, cambiando la sustancia a valorar. En vez de valorar el analito original se añade un exceso conocido de reactivo estándar a la disolución, y luego se valora el exceso. Este método es útil si el punto final de la valoración por retroceso es más fácil de identificar que el punto final de la valoración normal. Se usa también si la reacción entre el analito y la sustancia titulante es muy lenta. Algunos usos particulares
Algunas valoraciones aplicables a lípidos
El número de yodo oscila entre 0 (ácidos grasos saturados) a 350. Una valoración redox con cambio de color permite indicar la cantidad de ácido graso insaturado libre en una muestra.[5]
El número de saponificación no es más que los miligramos de KOH necesarios para saponificar 1 gramo de materia grasa. Esta prueba es otra prueba cualitativa que podemos aplicar a los lípidos. Esta nos permite ver si el tipo de lípido es saponificable (contiene ácidos grasos) o no (no contiene ácidos grasos). Se realiza una valoración ácido-base por retroceso con indicador de cambio de color o valoración potenciométrica para obtener una idea de la longitud media de la cadena de ácidos grasos en una grasa. Método Winkler para determinación de oxígeno disueltoEl método de Winkler[6] permite determinar la cantidad de mg/l de oxígeno disuelto a través de una valoración química.
Referencias
Enlaces externos
Categoría: Química |
| Este articulo se basa en el articulo Valoración_química publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




![pH = pK_a + \log \left( \frac{[\mbox{base}]}{[\mbox{acido}]} \right)](images/math/5/5/8/558de05791c15082741f7b62ac63dfd7.png)
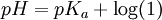
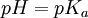
![pH = - \log [{H^+}] \,](images/math/e/5/7/e577e484948188f080d762c268e86319.png) por otra parte:
por otra parte:  , y finalmente, :
, y finalmente, :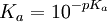
 (el Ka real es 1.7×10-5)
Para
(el Ka real es 1.7×10-5)
Para 