Avance en la electrólisis ácida del agua a través de catalizadores a base de rutenio
El combustible de hidrógeno, con las ventajas de ser limpio, renovable y de alta eficiencia de combustible, es visto como el "combustible definitivo" y está recibiendo más atención en todo el mundo. La electrólisis del agua es una forma ideal de producir hidrógeno, pero requiere catalizadores activos y estables que hagan que este proceso sea más eficiente y barato. Sin los catalizadores adecuados, convertir el agua en combustible parece demasiado bueno para ser cierto.

La reacción de evolución del oxígeno (OER) y la reacción de reducción de oxígeno (ORR) pueden considerarse como dos trofeos en el campo de la utilización eficiente de la energía del hidrógeno. Sin embargo, en la TEA ácida, se necesitaba un alto potencial aplicado y la estabilidad del catalizador es muy pobre, lo que resultó en una cinética lenta. Con el catalizador Ru, el proceso se acelera significativamente.
CUI Jie
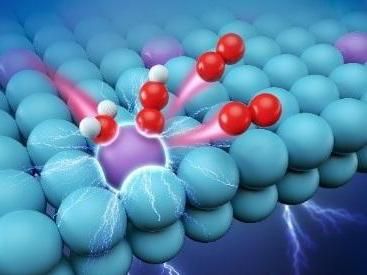
Ru se dispersó atómicamente en un soporte metálico. En un ambiente de electrolito ácido, las moléculas de agua fueron adsorbidas en el sitio activo del átomo Ru bajo el potencial aplicado, y luego el catalizador Ru de un solo átomo estimula la electrólisis ácida del agua produciendo oxígeno a través del mecanismo OOH. (Las bolas púrpura, azul, roja y blanca representan los átomos Ru, Pt, O y H, respectivamente.)
WU Yuen

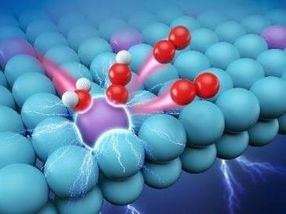
Afortunadamente, un estudio reciente está acercando este sueño. El equipo del profesor WU Yuen de la Universidad de Ciencia y Tecnología de China (USTC) preparó con éxito una especie de catalizador de aleación de un solo átomo de rutenio, que acelera enormemente el proceso de electrólisis del agua con un menor sobrepotencial (220 mV).
El grupo preparó con éxito un catalizador de rutenio (Ru) de un solo átomo mediante ingeniería de defectos de superficie para capturar y estabilizar átomos individuales. El catalizador de un solo átomo Ru ofrece un sobrepotencial de 90 mV menos para alcanzar una densidad de corriente de 10 mA/cm2, y un orden de magnitud con una vida útil más larga que la del RuO2 comercial.
En este estudio, los investigadores construyeron una serie de Ru1 soportadas por aleaciones usando diferentes aleaciones de PtCu a través del grabado ácido secuencial y la lixiviación electroquímica. También encontraron una relación volcánica entre la actividad de la reacción de evolución de oxígeno (OER) y la constante de red de las aleaciones de PtCu. Las investigaciones de la teoría funcional de la densidad revelan que la tensión compresiva de la cáscara de Pt-skin crea la estructura electrónica del Ru1, permitiendo una unión optimizada de las especies de oxígeno y una mejor resistencia a la sobreoxidación y disolución.
En comparación con los sistemas basados en Iridio, que tienen mejor resistencia a la disolución, los basados en Ru tienen reservas más abundantes y han sido evaluados como catalizadores OER más activos debido a su menor sobrepotencial.
Esta investigación hace que la producción de hidrógeno a través de la electrólisis del agua sea más fácil y eficiente, y permite a la gente ver el gran potencial del hidrógeno como una nueva energía alternativa en el futuro.
Sin embargo, hasta ahora, el problema de estabilidad del catalizador no se ha resuelto completamente. "Todavía quedan muchas exploraciones para mejorar aún más el sistema de reacción y vamos a seguir diseñando experimentos y tratando de encontrar la mejor manera de impulsar la actividad y la estabilidad de los catalizadores", dijo el Dr. YAO.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.























































