Los microorganismos construyen las mejores pilas de hidrógeno de bajo consumo de combustible
A pesar de todos los avances que la tecnología ha hecho a lo largo de nuestras vidas, en muchos casos respalda lo que la naturaleza puede hacer. Las hormigas pueden cargar 5000 veces su peso, y las telarañas son cinco veces más fuertes que el acero. La eficiencia del combustible no es diferente. En un nuevo estudio visto en Angewandte Chemie International Edition, investigadores del Instituto Nara de Ciencia y Tecnología (NAIST) reportan nuevos detalles sobre la vía de transferencia de protones de níquel-hierro [NiFe]-hidrogenasa usando espectroscopia infrarroja por transferencia de Fourier (FT-IR). Esta transferencia es crucial para el metabolismo del hidrógeno de los microorganismos, y el estudio da a los científicos una mejor comprensión de cómo imitar la naturaleza en la construcción de nuevas células de biocombustible.
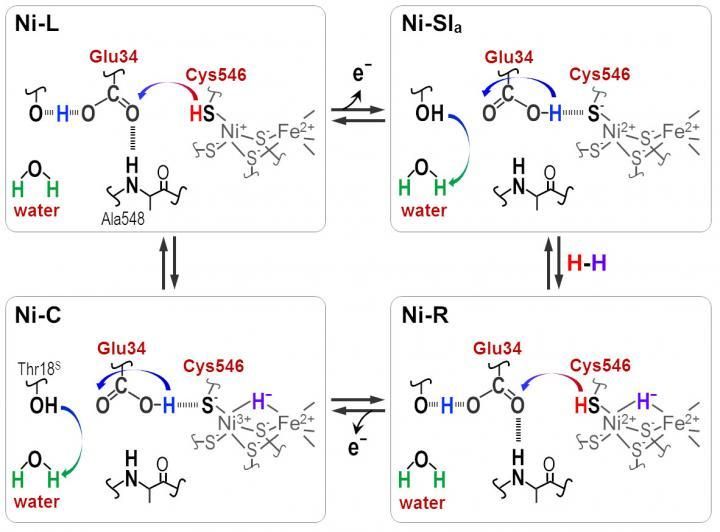
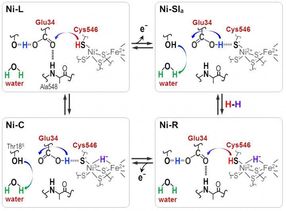
Los protones se transfieren entre el sitio activo de NiFe y la proteína circundante a través de los residuos de Cyt546 y Glu34 durante la reacción catalítica de la hidrogenasa [NiFe].
Shun Hirota
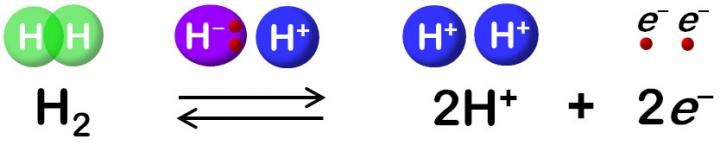
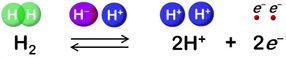
La hidrogenasa cataliza la oxidación reversible del H2.
Shun Hirota
El metabolismo del hidrógeno es una de las formas más antiguas de producción de energía para la vida y una de las más estudiadas por su importancia en la evolución. También ha llamado la atención por ser una fuente de energía limpia. Entre las enzimas responsables del metabolismo del hidrógeno, la [NiFe]-hidrogenasa es la más abundante y antigua.
Se sabe mucho sobre la enzima. Oxida reversiblemente los átomos de hidrógeno a través de su sitio activo Ni-Fe, que está rodeado de aminoácidos específicos. Sin embargo, señala el profesor del NAIST Shun Hirota, que dirigió el estudio, es necesario comprender ciertos fundamentos de las reacciones químicas antes de utilizar esta nanomáquina para diseñar tecnologías de biocombustibles.
"El hidruro y el protón se coordinan con el sitio Ni-Fe en el ciclo de desprotonación de la protonación, resultando en cuatro estados de hidrogenasa. Pero la vía de transferencia de protones sigue siendo desconocida", dice.
Una de las razones de la falta de claridad ha sido la incapacidad de resolver las frecuencias de estiramiento de los diferentes enlaces de hidrógeno. En el nuevo trabajo, el equipo de Hirota, en colaboración con otros investigadores de Japón y China, resolvió este problema observando fotoconversiones de tres estados de hidrodesasa con espectros FT-IR.
Distintas frecuencias de absorbancia revelaron que una de las cuatro cisteínas, la cisteína 546, junto con otro aminoácido, el ácido glutámico 34, y una molécula de agua ordenada son cruciales para la transferencia. Los científicos usaron la nueva información para deducir cómo la molécula de azufre de la cisteína 546 y el grupo ácido en el ácido glutámico 34 forman enlaces de hidrógeno para regular el transporte de hidrógeno.
"Nuestros resultados muestran que la cisteína 546 es un donante y receptor de protones en el ciclo de la hidrogenasa [Ni-Fe]. También demuestran cómo se forma un enlace de hidrógeno de baja barrera para el ácido glutámico 34 y cómo se rompe durante el ciclo catalítico", señala Hirota.
Los microorganismos se han adaptado a una gama más amplia de condiciones ambientales que los humanos. Se pueden encontrar en el clima confortable de nuestras habitaciones en los ambientes más hostiles de la tierra. Por lo tanto, ver cómo el sitio [Ni-Fe] de la hidrogenasa [Ni-Fe] transfiere protones de manera óptima proporciona un paradigma para los investigadores que buscan fabricar catalizadores de energía de alta eficiencia bajo una serie de condiciones.
"La vida ha pasado miles de millones de años adaptándose a la energía. Creemos que nos da el mejor modelo de eficiencia energética en el futuro", dice Hirota.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
![Visualización de la catálisis de la [Fe]-hidrogenasa mediante espectroscopia de resonancia magnética nuclear potenciada con parahidrógeno](https://img.chemie.de/Portal/News/675fd46b9b54f_sBuG8s4sS.png?tr=w-712,h-534,cm-extract,x-0,y-16:n-zoom)




















































