La síntesis de amoníaco es fácil con un catalizador 2D
Científicos desarrollan procesos inorgánicos para la producción en pequeña escala
Los investigadores de la Universidad del Arroz han desarrollado un método inorgánico para sintetizar el amoníaco que es amigable con el medio ambiente y puede producir el valioso producto químico bajo demanda en condiciones ambientales.
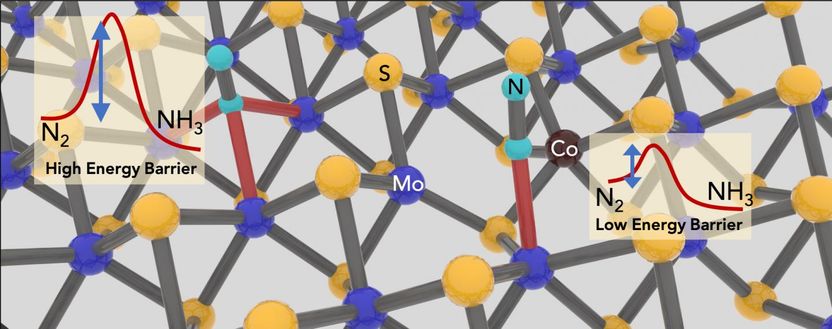
La adición de átomos de cobalto para llenar vacantes en cristales de disulfuro de molibdeno 2D mejora la capacidad del material para catalizar el amoníaco del dinitrógeno. Los científicos de la Universidad de Rice han desarrollado un método "verde" para la síntesis a pequeña escala de amoniaco que utiliza menos energía y produce menos dióxido de carbono que los procesos industriales.
Lou Group/Rice University
El laboratorio de la Escuela Brown de Ingeniería del científico de materiales Jun Lou manipuló un cristal bidimensional que entiende bien - el disulfuro de molibdeno - y lo convirtió en un catalizador al remover los átomos de azufre de la estructura lattiforme y reemplazar el molibdeno expuesto con cobalto.
Esto permitió que el material imitara el proceso orgánico natural que usan las bacterias para convertir el dinitrógeno atmosférico en amoníaco en los organismos, incluyendo a los humanos, que utilizan el amoníaco para ayudar a la función hepática.
El proceso inorgánico permitirá que el amoníaco se produzca en cualquier lugar donde se necesite como un complemento a pequeña escala de la industria, que produce millones de toneladas del químico cada año a través del proceso inorgánico Haber-Bosch.
"El proceso Haber-Bosch produce mucho dióxido de carbono y consume mucha energía", dijo Xiaoyin Tian, coautor y estudiante graduado de Rice. "Pero nuestro proceso usa electricidad para activar el catalizador. Podemos obtenerlo de la energía solar o del viento".
Los investigadores ya sabían que el disulfuro de molibdeno tenía una afinidad por enlazarse con el dinitrógeno, una molécula natural de dos átomos de nitrógeno fuertemente enlazados que forma alrededor del 78% de la atmósfera de la Tierra.
Las simulaciones computacionales realizadas por Mingjie Liu, una investigadora asociada del Laboratorio Nacional Brookhaven, mostraron que reemplazar algunos átomos de molibdeno expuestos con cobalto mejoraría la capacidad del compuesto para facilitar la reducción del dinitrógeno al amoníaco.
Las pruebas de laboratorio en Rice mostraron que esto era así. Los investigadores reunieron muestras del material a nanoescala cultivando cristales de disulfuro de molibdeno defectuosos sobre tela de carbono y añadiendo cobalto. (Los cristales son técnicamente 2D pero aparecen como un plano de átomos de molibdeno con capas de azufre por encima y por debajo.) Con la corriente aplicada, el compuesto produjo más de 10 gramos de amoníaco por hora usando 1 kilogramo de catalizador.
"La escala no es comparable a los procesos industriales bien desarrollados, pero puede ser una alternativa en casos específicos", dijo el co-líder Jing Zhang, investigador postdoctoral de Rice. "Permitirá la producción de amoníaco donde no hay plantas industriales, e incluso en aplicaciones espaciales." Dijo que los experimentos de laboratorio usaban alimentaciones dedicadas de dinitrógeno, pero que la plataforma también puede tirar de ella desde el aire.
Lou dijo que otros dopantes podrían permitir que el material catalizara otras sustancias químicas, un tema para estudios futuros. "Pensamos que había una oportunidad aquí para tomar algo con lo que estamos muy familiarizados y tratar de hacer lo que la naturaleza ha estado haciendo durante miles de millones de años", dijo. "Si diseñamos un reactor de la manera correcta, la plataforma puede llevar a cabo su función sin interrupción."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.