Los científicos finalmente rompen el vínculo químico más común de la naturaleza
El santo grial de la síntesis: Los enlaces carbono-hidrógeno en las moléculas de hidrocarburos se han resistido a la funcionalización hasta ahora
El vínculo químico más común en el mundo viviente - el que existe entre el carbono y el hidrógeno - ha resistido durante mucho tiempo los intentos de los químicos de abrirlo, frustrando los esfuerzos de añadir nuevas campanas y silbidos a las viejas moléculas basadas en el carbono.
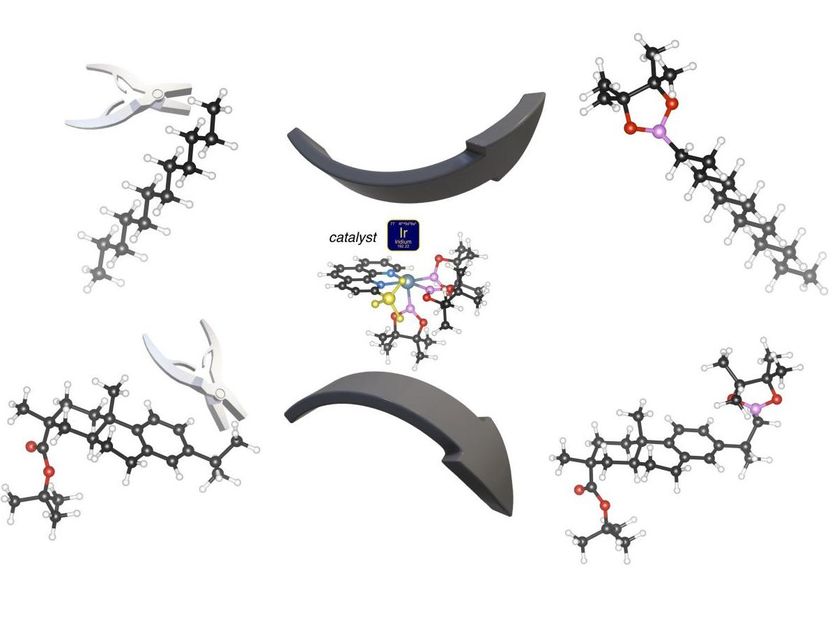
Un catalizador (centro) basado en iridio (bola azul) puede cortar un átomo de hidrógeno (bolas blancas) de un grupo metilo terminal (arriba y abajo a la izquierda) para añadir un compuesto de boro y oxígeno (rosa y rojo) que se puede cambiar fácilmente por grupos químicos más complicados. La reacción funciona con cadenas de hidrocarburos simples (reacción superior) o con compuestos de carbono más complicados (reacción inferior). La exquisita selectividad de esta reacción catalítica se debe al grupo metilo (amarillo) que se ha añadido al catalizador de iridio. Las bolas negras son átomos de carbono; las rojas son oxígeno; las rosadas son boro.
John Hartwig, UC Berkeley
Ahora, después de casi 25 años de trabajo de los químicos de la Universidad de California, Berkeley, esos enlaces de hidrocarburos -- dos tercios de todos los enlaces químicos en el petróleo y los plásticos -- han cedido completamente, abriendo la puerta a la síntesis de una amplia gama de nuevas moléculas orgánicas, incluyendo drogas basadas en compuestos naturales.
"Los enlaces de carbono-hidrógeno son normalmente parte del marco, la parte inerte de una molécula", dijo John Hartwig, el presidente de Henry Rapoport en Química Orgánica en UC Berkeley. "Ha sido un desafío y un santo grial de la síntesis poder hacer reacciones en estas posiciones porque, hasta ahora, no ha habido ningún reactivo o catalizador que le permita añadir algo en el más fuerte de estos enlaces".
Hartwig y otros investigadores habían mostrado previamente cómo añadir nuevos grupos químicos a los enlaces C-H que son más fáciles de romper, pero sólo podían añadirlos a las posiciones más fuertes de las cadenas de hidrocarburos simples.
En la edición del 15 de mayo de la revista Science, Hartwig y sus colegas de la UC Berkeley describieron cómo usar un catalizador recientemente diseñado para añadir grupos químicos funcionales a los enlaces carbono-hidrógeno más difíciles de romper: los enlaces, típicamente en la cabeza o cola de una molécula, donde un carbono tiene tres átomos de hidrógeno unidos, lo que se llama un grupo metilo (CH3).
"Los enlaces primarios C-H, los que se encuentran en un grupo metilo terminal de una cadena, son los menos ricos en electrones y los más fuertes", dijo. "Tienden a ser los menos reactivos de los enlaces C-H".
El becario postdoctoral de la Universidad de Berkeley, Raphael Oeschger, descubrió una nueva versión de un catalizador basado en el metal iridio que abre uno de los tres enlaces C-H en un grupo metilo terminal e inserta un compuesto de boro, que puede ser fácilmente reemplazado por grupos químicos más complejos. El nuevo catalizador era más de 50 veces más eficiente que los catalizadores anteriores e igual de fácil de trabajar.
"Ahora tenemos la capacidad de hacer este tipo de reacciones, lo que debería permitir a las personas hacer rápidamente moléculas que no habrían hecho antes", dijo Hartwig. "Yo no diría que estas son moléculas que no podrían haber sido hechas antes, pero la gente no las haría porque tomaría demasiado tiempo, demasiado esfuerzo de investigación, para hacerlas".
La recompensa podría ser enorme. Cada año, la industria utiliza casi mil millones de libras de hidrocarburos para fabricar solventes, refrigerantes, retardantes de fuego y otros productos químicos, y son el típico punto de partida para la síntesis de drogas.
La "Cirugía experta" en hidrocarburos
Para probar la utilidad de la reacción catalítica, el becario postdoctoral de la Universidad de Berkeley, Bo Su, y sus compañeros de trabajo en el laboratorio, la usaron para añadir un compuesto de boro, o borano, a un átomo de carbono terminal, o primario, en 63 estructuras moleculares diferentes. El borano puede entonces ser cambiado por cualquier número de grupos químicos. La reacción apunta específicamente a los enlaces C-H terminales, pero funciona en otros enlaces C-H cuando una molécula no tiene un C-H terminal.
"Hacemos un enlace boro-carbono usando boranos como reactivos -- están a sólo un par de pasos del veneno para hormigas, el ácido bórico -- y ese enlace carbono-boro puede ser convertido en muchas cosas diferentes", dijo Hartwig. "Clásicamente, se puede hacer un enlace carbono-oxígeno a partir de eso, pero también se puede hacer un enlace carbono-nitrógeno, un enlace carbono-carbono, un enlace carbono-flúor u otros enlaces carbono-halógeno". Así que, una vez que haces ese enlace carbono-boro, hay muchos compuestos diferentes que se pueden hacer".
El químico orgánico Varinder Aggarwal de la Universidad de Bristol se refirió a la reacción catalítica como "cirugía experta" y caracterizó la nueva técnica de la UC Berkeley como "sofisticada e inteligente", según la revista Chemical and Engineering News
Una aplicación potencial, dijo Hartwig, es la alteración de los compuestos naturales - productos químicos de plantas o animales que tienen propiedades útiles, como la actividad antibiótica - para mejorarlos. Muchas compañías farmacéuticas hoy en día se centran en lo biológico -moléculas orgánicas, como las proteínas, usadas como fármacos- que también podrían ser alteradas con esta reacción para mejorar su eficacia.
"En el curso normal, tendrías que volver y rehacer todas esas moléculas desde el principio, pero esta reacción podría permitirte hacerlas directamente", dijo Hartwig. "Este es un tipo de química que te permitiría tomar esas complejas estructuras que la naturaleza hace que tienen una actividad biológica inherente y mejorar o alterar esa actividad biológica haciendo pequeños cambios en la estructura".
Dijo que los químicos también podían añadir nuevos grupos químicos a los extremos de las moléculas orgánicas para prepararlas para la polimerización en largas cadenas nunca antes sintetizadas.
"Podría permitir tomar moléculas que serían naturalmente abundantes, moléculas de origen biológico como los ácidos grasos, y ser capaz de derivarlas en el otro extremo para propósitos de polímeros", dijo.
La larga historia de la Universidad de Berkeley con los enlaces C-H
Los químicos han intentado durante mucho tiempo hacer adiciones específicas a los enlaces de carbono-hidrógeno, una reacción conocida como activación C-H. Un sueño aún no alcanzado es convertir el metano - un abundante, pero a menudo desperdiciado, subproducto de la extracción de petróleo y un potente gas de efecto invernadero - en un alcohol llamado metanol que puede ser utilizado como punto de partida en muchas síntesis químicas en la industria.
En 1982, Robert Bergman, ahora profesor emérito de química de la Universidad de Berkeley, demostró por primera vez que un átomo de iridio podía romper un enlace C-H en una molécula orgánica e insertarse a sí mismo y a un ligando entre el carbono y el hidrógeno. Mientras que un gran avance en la química orgánica e inorgánica, la técnica era poco práctica - requería un átomo de iridio por cada enlace C-H. Diez años más tarde, otros investigadores encontraron una forma de utilizar el iridio y otros metales llamados de transición, como el tungsteno, como catalizador, donde un solo átomo podía romper y funcionalizar millones de enlaces C-H.
Hartwig, quien fue un estudiante de posgrado con Bergman a finales de la década de 1980, continuó golpeando los enlaces C-H no reactivos y en el año 2000 publicó un artículo en Science describiendo cómo usar un catalizador basado en el rodio para insertar boro en los enlaces C-H terminales. Una vez insertado el boro, los químicos podían cambiarlo fácilmente por otros compuestos. Con las subsiguientes mejoras de la reacción y el cambio del metal de rodio a iridio, algunos fabricantes han utilizado esta reacción catalítica para sintetizar medicamentos modificando diferentes tipos de enlaces C-H. Sin embargo, la eficiencia de las reacciones en los enlaces metilo C-H en los extremos de las cadenas de carbono siguió siendo baja, porque la técnica requería que los productos químicos reactivos fueran también el disolvente.
Con la adición de la nueva reacción catalítica, los químicos pueden ahora pegar productos químicos en casi cualquier tipo de enlace carbono-hidrógeno. En la reacción, el iridio corta un átomo de hidrógeno terminal y el boro lo reemplaza; otro compuesto de boro flota con el átomo de hidrógeno liberado. El equipo unió un nuevo ligando al iridio, un grupo metilo llamado 2-metilfenantrolina, que aceleró la reacción entre 50 y 80 veces más que los resultados anteriores.
Hartwig reconoce que estos experimentos son un primer paso. Las reacciones varían entre el 29% y el 85% en su rendimiento del producto final. Pero está trabajando en mejoras.
"Para nosotros, se muestra, sí, se puede hacer esto, pero tendremos que hacer catalizadores aún mejores. Sabemos que el objetivo final es alcanzable si podemos aumentar nuestras tasas en un factor de 10, digamos. Entonces, deberíamos ser capaces de aumentar la complejidad de las moléculas para esta reacción y lograr mayores rendimientos", dijo Hartwig. "Es un poco como una milla de cuatro minutos. Una vez que sabes que algo se puede lograr, mucha gente es capaz de hacerlo, y lo siguiente que sabes, es que estamos corriendo una milla de tres y tres cuartos de minuto".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.























































