Hora del espectáculo para la fotosíntesis
Una de las reacciones químicas más importantes de la naturaleza está siendo capturada en una revolucionaria "película molecular
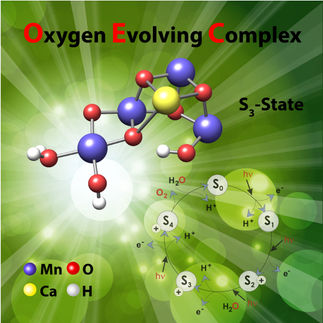
Utilizando una combinación única de imágenes a nanoescala y análisis químicos, un equipo internacional de investigadores ha revelado un paso clave en el mecanismo molecular detrás de la reacción de división del agua de la fotosíntesis, un hallazgo que podría ayudar a informar el diseño de la tecnología de energía renovable.

Ilustración
Greg Stewart/SLAC National Accelerator Laboratory
"La vida depende del oxígeno que las plantas y las algas separan del agua; cómo lo hacen sigue siendo un misterio, pero los científicos, incluido nuestro equipo, están lentamente desprendiendo las capas para llegar a la respuesta", dijo Vittal K. Yachandra, co-autor principal de un nuevo estudio publicado en el PNAS y químico principal del Laboratorio Lawrence Berkeley del Departamento de Energía (DOE). "Si podemos entender este paso de la fotosíntesis natural, nos permitiría usar esos principios de diseño para construir sistemas fotosintéticos artificiales que produzcan energía limpia y renovable a partir de la luz solar y el agua".
Con un instrumento que el equipo diseñó y fabricó, analizaron las proteínas fotosintéticas usando tanto cristalografía de rayos X como espectroscopia de emisión de rayos X. Este enfoque dual, del que el equipo fue pionero y que ha estado perfeccionando durante los últimos 10 años, genera información sobre la estructura química y proteínica de la misma muestra al mismo tiempo. La toma de imágenes se realizó con el láser de electrones libres de rayos X (XFEL) en el LCLS del Laboratorio Nacional SLAC, y en el SACLA en Japón.
"Con esta técnica, obtenemos la imagen general de cómo la estructura completa de la proteína cambia dinámicamente y vemos las complejidades químicas que ocurren en el sitio de la reacción", dijo la co-autora principal Junko Yano, una química científica principal de la División de Biofísica Molecular y Bioimágenes Integradas (MBIB) del Laboratorio de Berkeley. "El láser de electrones libres de rayos X produce ráfagas extremadamente brillantes y cortas de rayos X que nos permiten no sólo analizar una proteína a temperatura ambiente, que es como estas reacciones ocurren en la naturaleza, sino también capturar varios momentos a lo largo de la escala de tiempo de reacción".
Los métodos tradicionales de cristalografía a menudo requieren que las proteínas de la muestra se congelen; en consecuencia, sólo pueden generar instantáneas de proteínas estáticas. Esta limitación dificulta a los científicos la comprensión del comportamiento real de las proteínas en los organismos vivos, ya que las moléculas se transforman entre diferentes estados físicos durante las reacciones químicas.
"La reacción de división del agua en la fotosíntesis es un proceso cíclico que necesita cuatro fotones y ciclos entre cuatro 'estados' estables", dijo Yano. "Anteriormente, sólo podíamos tomar fotos de estos cuatro estados. Pero al tomar múltiples instantáneas a tiempo, ahora podemos visualizar cómo un estado pasa al otro".
"Vimos, muy bien, cómo la estructura cambia paso a paso a medida que se transforma de un estado a otro", dijo Jan F. Kern, químico y coautor de MBIB. "Es bastante emocionante, porque podemos ver la 'causa y efecto' y el papel que cada átomo en movimiento juega en esta transición".
Nicholas K. Sauter, co-autor y científico senior de computación del MBIB, añadió: "Esencialmente, estamos tratando de tomar una 'película' de una reacción química. Hicimos muchos progresos para llegar a este punto, en términos de nuestra tecnología y nuestros análisis computacionales. El trabajo de nuestro co-autor Paul Adams y otros en MBIB fue crítico para interpretar el XFEL y los datos de rayos X. Pero todavía tenemos que conseguir los otros cuadros para ver cómo se completa la reacción y la enzima está lista para el próximo ciclo".
Los investigadores del Berkeley Lab esperan continuar el proyecto una vez que los muchos sitios de investigación en los que se basa todo el equipo internacional - ubicados en los EE.UU., Japón, Suiza y Corea del Sur - estén operando normalmente después de la pandemia de COVID-19.
Kern concluyó señalando que el hito tecnológico presentado en este documento se benefició enormemente de la diversa experiencia de los autores de las universidades de SLAC, Uppsala y Umeå en Suecia, la Universidad Humboldt en Alemania, y de las capacidades de cinco instalaciones para usuarios de la Oficina de Ciencias del DOE: la Fuente de Radiación de Sincrotrón de Stanford y LCLS en la Universidad de Stanford, y la Fuente de Luz Avanzada, la Red de Ciencias Energéticas, y el Centro Nacional de Computación Científica de Investigación Energética en el Laboratorio de Berkeley.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.