Las enzimas antiguas pueden contribuir a una química más ecológica
Las enzimas de varios miles de millones de años de antigüedad resucitaron y una reacción no natural completamente nueva catalizó
Un equipo de investigación de la Universidad de Uppsala ha resucitado enzimas de varios miles de millones de años de antigüedad y las ha reprogramado para catalizar reacciones químicas completamente diferentes de las que sus versiones modernas pueden manejar. El método puede utilizarse para desarrollar soluciones sostenibles dentro de la biotecnología, como por ejemplo para biorreactores de enzimas o para degradar químicamente toxinas ambientales.
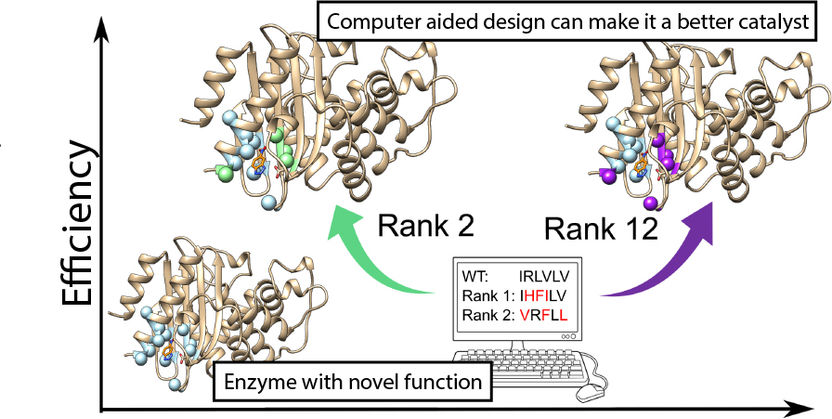
A partir de las antiguas estructuras proteínicas, es posible crear enzimas para nuevas reacciones químicas y utilizar la computación bioinformática para mejorarlas.
https://pubs.rsc.org/en/content/articlelanding/2020/sc/d0sc01935f
"Utilizamos software para simular miles de millones de años de evolución, y fuimos capaces de desarrollar una enzima efectiva que puede catalizar una reacción completamente nueva. Es increíblemente excitante", dice Lynn Kamerlin, que dirige el equipo de investigación de la Universidad de Uppsala.
Las enzimas tienen la capacidad de catalizar, es decir, de acelerar, desafiando las reacciones químicas de millones de años a una fracción de segundo sin consumirse ellas mismas. También son biodegradables y tienen una huella de carbono mínima. La mayoría de las enzimas son catalizadores de una reacción química específica, que cumple una función importante en los procesos biológicos, por ejemplo en nuestro cuerpo.
Dentro de la biotecnología, se está trabajando intensamente en el desarrollo de nuevas enzimas que puedan catalizar reacciones inusuales para la química verde, la catálisis sostenible y la descomposición química de sustancias tóxicas para el medio ambiente.
El equipo de investigación de la Universidad de Uppsala ha trabajado con colegas de la Universidad de Granada en España para resucitar enzimas ancestrales, primero en un ordenador y luego en el laboratorio. Las enzimas primitivas tienen muchas características que son deseables dentro de la biotecnología. Pueden soportar temperaturas extremas y son estructuralmente más flexibles, lo que las hace más fáciles de modificar que sus equivalentes modernas.
Los investigadores lograron reutilizar antiguas enzimas degradadoras de antibióticos para catalizar una reacción no natural completamente nueva. Pero aunque las enzimas readaptadas aceleraron la reacción de manera significativa, fue mucho más lenta que la mayoría de las enzimas naturales.
Por lo tanto, para mejorar la eficiencia de la enzima, los investigadores utilizaron potentes ordenadores para calcular qué cambios en la estructura darían lugar a una reacción más rápida. Utilizaron un nuevo método llamado FuncLib, que utiliza una combinación de información evolutiva y cálculos de estabilidad de la proteína, para predecir variantes enzimáticas más eficaces.
FuncLib predijo un total de 3.000 nuevas variantes enzimáticas potenciales y las 20 más prometedoras se probaron en el laboratorio. De ellas, cuatro fueron mucho más rápidas que la enzima original. La mejor fue tan efectiva como la media de las enzimas modernas y naturales.
"Nuestro estudio muestra que es posible diseñar nuevas y efectivas enzimas para un futuro más sostenible", dice Lynn Kamerlin.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.