Conversión a temperatura ambiente de CO₂ a CO: Una nueva forma de sintetizar hidrocarburos
El nuevo método podría reducir potencialmente la emisión de dióxido a la atmósfera y recortar los costos de fabricación de productos químicos
Los investigadores del Instituto Nacional de Estándares y Tecnología (NIST) y sus colegas han demostrado un método a temperatura ambiente que podría reducir significativamente los niveles de dióxido de carbono en los gases de escape de las centrales eléctricas de combustibles fósiles, una de las principales fuentes de emisiones de carbono en la atmósfera.
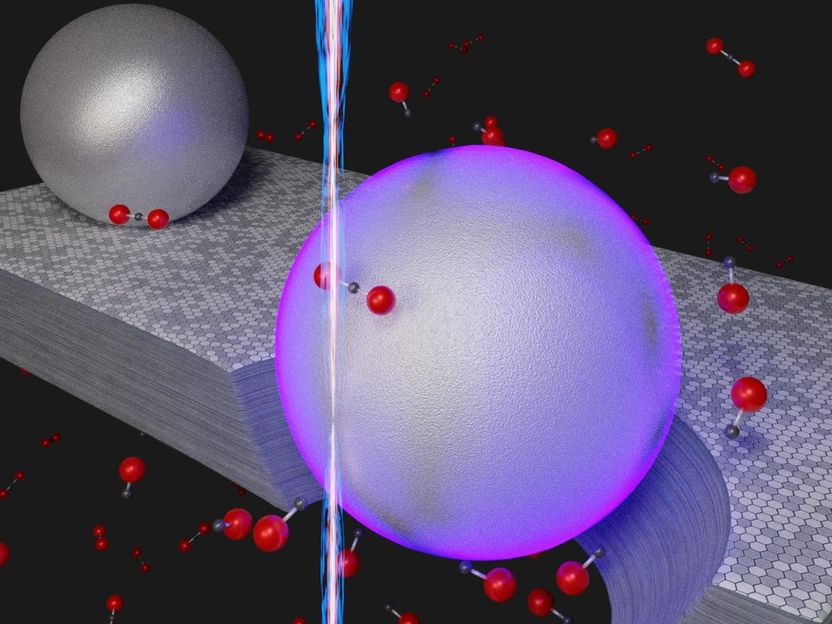
Ilustración de un novedoso proceso a temperatura ambiente para eliminar el dióxido de carbono (CO₂) mediante la conversión de la molécula en monóxido de carbono (CO). En lugar de utilizar el calor, el método a nanoescala se basa en la energía de los plasmones de la superficie (de color violeta) que se excitan cuando un haz de electrones (haz vertical) choca contra las nanopartículas de aluminio que descansan sobre el grafito, una forma cristalina de carbono. En presencia del grafito, ayudado por la energía derivada de los plasmones, las moléculas de dióxido de carbono (punto negro unido a dos puntos rojos) se convierten en monóxido de carbono (punto negro unido a un punto rojo. El agujero bajo la esfera violeta representa el grafito grabado durante la reacción química CO₂ + C = 2CO.
NIST
Aunque los investigadores demostraron este método en un entorno de pequeña escala y altamente controlado con dimensiones de tan sólo nanómetros (mil millonésimas de metro), ya han elaborado conceptos para ampliar el método y hacerlo práctico para aplicaciones en el mundo real.
Además de ofrecer una nueva forma potencial de mitigar los efectos del cambio climático, el proceso químico empleado por los científicos también podría reducir los costos y las necesidades de energía para producir hidrocarburos líquidos y otros productos químicos utilizados por la industria. Esto se debe a que los subproductos del método incluyen los bloques de construcción para sintetizar el metano, el etanol y otros compuestos basados en el carbono utilizados en el procesamiento industrial.
El equipo aprovechó una nueva fuente de energía del nanomundo para desencadenar una reacción química corriente que elimina el dióxido de carbono. En esta reacción, el carbono sólido se adhiere a uno de los átomos de oxígeno del gas de dióxido de carbono, reduciéndolo a monóxido de carbono. La conversión normalmente requiere cantidades significativas de energía en forma de calor elevado, una temperatura de al menos 700 grados centígrados, lo suficientemente caliente como para derretir el aluminio a una presión atmosférica normal.
En lugar de calor, el equipo se basó en la energía cosechada de las ondas de electrones que viajan, conocidas como plasmones de superficie localizados (LSP), que se desplazan sobre nanopartículas individuales de aluminio. El equipo desencadenó las oscilaciones de los LSP excitando las nanopartículas con un haz de electrones de diámetro ajustable. Un estrecho haz, de aproximadamente un nanómetro de diámetro, bombardeaba las nanopartículas de aluminio individuales mientras que un haz unas mil veces más ancho generaba LSPs entre un gran conjunto de las nanopartículas.
En el experimento del equipo, las nanopartículas de aluminio se depositaron en una capa de grafito, una forma de carbono. Esto permitió que las nanopartículas transfirieran la energía de las LSP al grafito. En presencia de gas de dióxido de carbono, que el equipo inyectó en el sistema, el grafito cumplió la función de extraer átomos individuales de oxígeno del dióxido de carbono, reduciéndolo a monóxido de carbono. Las nanopartículas de aluminio se mantuvieron a temperatura ambiente. De esta manera, el equipo logró una gran hazaña: deshacerse del dióxido de carbono sin necesidad de una fuente de calor elevado.
Los métodos anteriores para eliminar el dióxido de carbono han tenido un éxito limitado debido a que las técnicas han requerido alta temperatura o presión, han empleado metales preciosos costosos o han tenido una eficiencia pobre. En cambio, el método LSP no sólo ahorra energía sino que utiliza aluminio, un metal barato y abundante.
Aunque la reacción LSP genera un gas venenoso - monóxido de carbono - el gas se combina fácilmente con el hidrógeno para producir compuestos de hidrocarburos esenciales, como el metano y el etanol, que se utilizan a menudo en la industria, dijo el investigador del NIST Renu Sharma.
Ella y sus colegas, incluyendo científicos de la Universidad de Maryland en College Park y DENSsolutions, en Delft, Holanda, reportaron sus hallazgos en Nature Materials.
"Demostramos por primera vez que esta reacción de dióxido de carbono, que de otro modo sólo se produciría a 700 grados C o más, puede ser desencadenada utilizando LSP a temperatura ambiente", dijo el investigador Canhui Wang del NIST y la Universidad de Maryland.
Los investigadores eligieron un rayo de electrones para excitar las LSPs porque el rayo también puede ser usado para tomar imágenes de estructuras en el sistema tan pequeñas como unas mil millonésimas de metro. Esto permitió al equipo estimar cuánto dióxido de carbono se había eliminado. Estudiaron el sistema utilizando un microscopio electrónico de transmisión (TEM).
Debido a que tanto la concentración de dióxido de carbono como el volumen de reacción del experimento eran tan pequeños, el equipo tuvo que tomar medidas especiales para medir directamente la cantidad de monóxido de carbono generado. Lo hicieron acoplando un soporte de celda de gas especialmente modificado del TEM a un espectrómetro de masas de cromatógrafo de gases, lo que permitió al equipo medir las concentraciones de partes por millón de dióxido de carbono.
Sharma y sus colegas también utilizaron las imágenes producidas por el haz de electrones para medir la cantidad de grafito que se había grabado durante el experimento, una aproximación de la cantidad de dióxido de carbono que se había eliminado. Descubrieron que la relación entre el monóxido de carbono y el dióxido de carbono medido a la salida del soporte de la célula de gas aumentaba linealmente con la cantidad de carbono eliminado por el grabado.
Las imágenes con el haz de electrones también confirmaron que la mayor parte del grabado de carbono, un sustituto de la reducción de dióxido de carbono, ocurrió cerca de las nanopartículas de aluminio. Estudios adicionales revelaron que cuando las nanopartículas de aluminio estuvieron ausentes del experimento, sólo se grabó alrededor de una séptima parte del carbono.
Limitado por el tamaño del haz de electrones, el sistema experimental del equipo era pequeño, sólo unos 15 o 20 nanómetros de diámetro (el tamaño de un pequeño virus).
Para ampliar el sistema de manera que pudiera eliminar el dióxido de carbono de los gases de escape de una central eléctrica comercial, un haz de luz podría ser una mejor opción que un haz de electrones para excitar a los LSP, dijo Wang. Sharma propone que un recinto transparente que contenga nanopartículas de carbono y aluminio sueltas podría colocarse sobre la chimenea de una central eléctrica. Una serie de rayos de luz que incidan en la red activaría las LSPs. Cuando los gases de escape pasen a través del dispositivo, las LSP activadas por la luz en las nanopartículas proporcionarían la energía para eliminar el dióxido de carbono.
Las nanopartículas de aluminio, que están disponibles comercialmente, deberían distribuirse uniformemente para maximizar el contacto con la fuente de carbono y el dióxido de carbono entrante, señaló el equipo.
El nuevo trabajo también sugiere que las LSP ofrecen una forma de realizar una serie de otras reacciones químicas que ahora requieren una gran infusión de energía para proceder a temperaturas y presiones ordinarias utilizando nanopartículas plasmónicas.
"La reducción del dióxido de carbono es un gran problema, pero sería aún más importante, ahorrando enormes cantidades de energía, si pudiéramos empezar a hacer muchas reacciones químicas a temperatura ambiente que ahora requieren calentamiento", dijo Sharma.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.






















































