El descubrimiento de la "química en cadena" abre una nueva frontera en la dinámica de las reacciones
Nuevos hallazgos experimentales ponen en duda un modelo teórico de 90 años sobre el estado de transición en las reacciones químicas
Una investigación realizada por un equipo de químicos de la Universidad de Toronto, dirigido por el investigador ganador del Premio Nobel John Polanyi, está arrojando nueva luz sobre el comportamiento de las moléculas cuando chocan e intercambian átomos durante una reacción química. El descubrimiento pone en duda un modelo teórico de 90 años sobre el comportamiento del "estado de transición", intermedio entre los reactivos y los productos en las reacciones químicas, abriendo un nuevo campo de investigación.
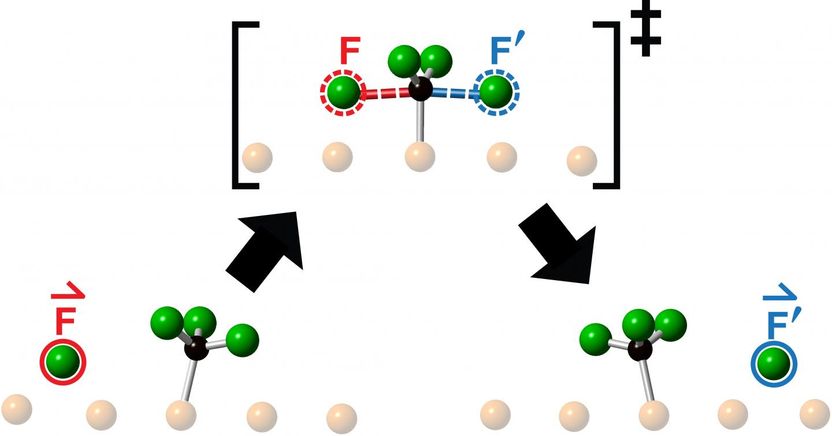
Interpretación artística de la barrera energética que debe atravesar un átomo de flúor reactivo al chocar con una molécula de fluorometilo en su camino hacia la formación de un producto como resultado de una reacción química. Los investigadores de la Universidad de Toronto observaron la expulsión colineal del producto de la reacción (rodeado de azul) en la dirección de la molécula reactiva entrante (rodeada de rojo).
Illustration: Lydie Leung
Los investigadores estudiaron las colisiones obtenidas al lanzar un átomo de flúor al centro de una molécula de fluorometilo -compuesta por un átomo de carbono y tres de flúor- y observaron la reacción resultante mediante microscopía de túnel de barrido. Lo que vieron tras cada colisión fue la expulsión de un nuevo átomo de flúor que se movía colinealmente a lo largo de la continuación de la dirección de aproximación del átomo de flúor entrante.
"Los químicos lanzan moléculas a otras moléculas todo el tiempo para ver qué pasa o con la esperanza de hacer algo nuevo", dice Polanyi, profesor universitario del Departamento de Química de la Facultad de Artes y Ciencias de la U de T y autor principal de un estudio publicado este mes en Communications Chemistry."Descubrimos que al apuntar una molécula reactiva al centro de una molécula objetivo, se restringe el movimiento del producto emergente a una sola línea, como si el producto hubiera sido directamente "golpeado". La sorprendente observación de que el producto de la reacción emerge en línea recta, moviéndose en la misma dirección que el átomo de reactivo entrante, sugiere que los movimientos que conducen a la reacción se asemejan a una simple transferencia de momento hacia adelante.
"La conservación del momento lineal que observamos aquí sugiere un "estado de transición" de corta duración, en lugar de la opinión anterior de que hay tiempo suficiente para la aleatorización del movimiento. Creo que Newton se habría alegrado de que la naturaleza permitiera un simple suceso de choque para describir algo tan complejo como una reacción química", afirma Polanyi.
El equipo, que incluye a la investigadora asociada Lydie Leung, al estudiante de posgrado Matthew Timm y al doctorado Kelvin Anggara, había establecido previamente los medios para controlar si una molécula lanzada hacia otra colisiona frontalmente con su objetivo o falla por una cantidad elegida, una cantidad conocida como parámetro de impacto. Cuanto más alto sea el parámetro de impacto, mayor será la distancia por la que la molécula entrante no alcance a la molécula objetivo. Para el nuevo trabajo, los investigadores emplearon un parámetro de impacto de cero para dar una colisión frontal.
"Llamamos a este nuevo tipo de reacción química unidimensional 'knock-on', ya que encontramos que el producto es golpeado a lo largo de la continuación de la dirección de aproximación del reactivo", dice Polanyi. "Los movimientos se asemejan al knock-on de las bolas de acero de una cuna de Newton. Las bolas de acero de la cuna no se atraviesan unas a otras, sino que transfieren eficazmente el impulso a lo largo de una sola línea.
"Del mismo modo, nuestras reacciones de knock-on transfieren energía a lo largo de filas de moléculas, favoreciendo así una reacción en cadena. Esta conservación de la energía de reacción en la química knock-on podría ser útil a medida que el mundo avanza hacia la conservación de la energía. Por ahora, sirve como ejemplo de reacción química en su forma más simple".
Desde hace más de un siglo se sabe que existe una barrera energética que los reactivos químicos deben atravesar en su camino hacia la formación de productos de reacción. Un estado de transición energizado existe brevemente en la parte superior de la barrera en una configuración crítica - sin estado de transición, no hay reacción.
Polanyi dice que la observación del "golpe" colineal proporciona una visión del complejo de colisiones reactivas, que dura aproximadamente una millonésima de segundo. "Nuestros resultados nos dicen claramente que el estado de transición en la cima de la barrera de energía dura tan poco tiempo que no puede revolver completamente sus momentos. En cambio, recuerda la dirección desde la que vino el átomo de flúor atacante".
En la década de 1930, los químicos empezaron a calcular la probabilidad de que se formara un estado de transición suponiendo que revolviera su energía, como una molécula caliente. Aunque era una suposición, parecía bien establecida y dio lugar a la "teoría del estado de transición" estadística de las velocidades de reacción. Éste sigue siendo el método preferido para calcular las velocidades de reacción.
"Ahora, con la capacidad de observar los reactivos y los productos a nivel molecular, se puede ver con precisión cómo se acercan los reactivos y, posteriormente, cómo se separan los productos", dice Polanyi. "Pero esto va en contra del modelo estadístico clásico de hace 90 años. Si la energía y el momento fueran aleatorios en el estado de transición caliente, los productos no mostrarían una memoria clara de la dirección de aproximación de los reactivos. La aleatorización de la energía serviría para borrar esa memoria".
Los investigadores afirman que el movimiento direccional observado de los productos de la reacción favorece un modelo determinista del estado de transición que sustituye al modelo estadístico vigente desde hace tiempo. Además, la dinámica de reacción observada permite que la energía de los reactivos se transmita en sucesivas colisiones colineales.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.