Nanopartículas: El complejo ritmo de la química
Las nanopartículas se utilizan a menudo como catalizadores. Las reacciones químicas en su superficie son más complejas de lo que se pensaba
La mayoría de los productos químicos comerciales se producen utilizando catalizadores. Normalmente, estos catalizadores consisten en diminutas nanopartículas metálicas que se colocan sobre un soporte oxidado. Al igual que un diamante tallado, cuya superficie consta de diferentes facetas orientadas en distintas direcciones, una nanopartícula catalítica también posee facetas cristalográficamente diferentes, y estas facetas pueden tener propiedades químicas distintas.
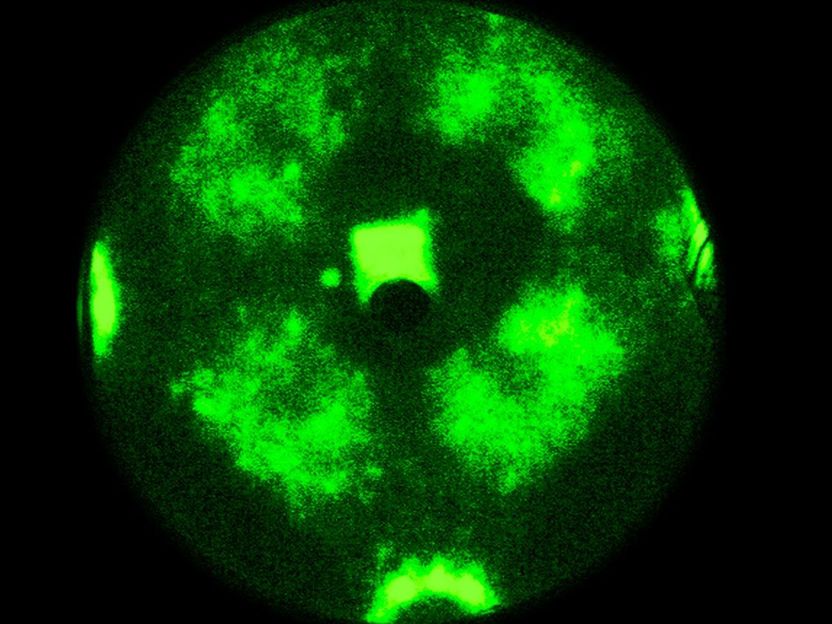
La reacción química se mueve a través de la nanopartícula como una onda
Technische Universität Wien
Hasta ahora, estas diferencias no se han tenido en cuenta en la investigación sobre la catálisis porque es muy difícil obtener simultáneamente información sobre la reacción química en sí y sobre la estructura superficial del catalizador. En la Universidad Técnica de Viena (TU Wien), esto se ha conseguido ahora combinando diferentes métodos microscópicos: con la ayuda de la microscopía electrónica de campo y la microscopía de iones de campo, se ha podido visualizar la oxidación del hidrógeno en una única nanopartícula de rodio en tiempo real con una resolución nanométrica. Esto reveló efectos sorprendentes que habrá que tener en cuenta en la búsqueda de mejores catalizadores en el futuro.
El ritmo de las reacciones químicas
"En determinadas reacciones químicas, un catalizador puede alternar periódicamente entre un estado activo y otro inactivo", explica el profesor Günther Rupprechter, del Instituto de Química de Materiales de la Universidad Técnica de Viena. "Pueden producirse oscilaciones químicas autosostenidas entre ambos estados: el químico Gerhard Ertl recibió el Premio Nobel de Química por este descubrimiento en 2007".
Este es también el caso de las nanopartículas de rodio, que se utilizan como catalizador para la oxidación del hidrógeno, la base de toda pila de combustible. En determinadas condiciones, las nanopartículas pueden oscilar entre un estado en el que las moléculas de oxígeno se disocian en la superficie de la partícula y un estado en el que el hidrógeno está unido.
El oxígeno incorporado cambia el comportamiento de la superficie
"Cuando una partícula de rodio se expone a una atmósfera de oxígeno e hidrógeno, las moléculas de oxígeno se dividen en átomos individuales en la superficie del rodio. Estos átomos de oxígeno pueden entonces migrar por debajo de la capa superior de rodio y acumularse como oxígeno subsuperficial allí", explica el profesor Yuri Suchorski, primer autor del estudio.
Mediante la interacción con el hidrógeno, estos átomos de oxígeno almacenados pueden volver a salir y reaccionar con átomos de hidrógeno. Entonces, vuelve a haber espacio para más átomos de oxígeno dentro de la partícula de rodio y el ciclo vuelve a empezar. "Este mecanismo de retroalimentación controla la frecuencia de las oscilaciones", afirma Yuri Suchorski.
Hasta ahora, se pensaba que estas oscilaciones químicas se producían siempre de forma sincronizada al mismo ritmo en toda la nanopartícula. Al fin y al cabo, los procesos químicos en las diferentes facetas de la superficie de la nanopartícula están acoplados espacialmente, ya que los átomos de hidrógeno pueden migrar fácilmente de una faceta a las adyacentes.
Sin embargo, los resultados del grupo de investigación del Prof. Günther Rupprechter y el Prof. Yuri Suchorski muestran que las cosas son en realidad mucho más complejas: bajo ciertas condiciones, el acoplamiento espacial se levanta y las facetas adyacentes oscilan de repente con frecuencias significativamente diferentes - y en algunas regiones de la nanopartícula, estas "ondas químicas" oscilantes no se propagan en absoluto.
"Esto puede explicarse a escala atómica", afirma Yuri Suchorski. "Bajo la influencia del oxígeno, pueden surgir filas de átomos de rodio que sobresalen de una superficie lisa". Estas filas de átomos pueden actuar entonces como una especie de "rompeolas" y dificultar la migración de los átomos de hidrógeno de una faceta a otra: las facetas se desacoplan.
Si este es el caso, las facetas individuales pueden formar oscilaciones de diferentes frecuencias. "En las distintas facetas, los átomos de rodio se disponen de forma diferente en la superficie", explica Günther Rupprechter. "Por eso, la incorporación de oxígeno bajo las distintas facetas de la partícula de rodio también procede a ritmos diferentes, y así se producen oscilaciones con frecuencias distintas en facetas cristalográficamente diferentes".
Una punta hemisférica como modelo de nanopartícula
La clave para desentrañar este complejo comportamiento químico reside en utilizar una fina punta de rodio como modelo de nanopartícula catalizadora. Se aplica un campo eléctrico y, debido al efecto de túnel mecánico cuántico, los electrones pueden salir de la punta. Estos electrones se aceleran en el campo eléctrico y chocan con una pantalla, donde se crea una imagen de proyección de la punta con una resolución de unos 2 nanómetros.
A diferencia de las microscopías de barrido, en las que los lugares de la superficie se escanean uno tras otro, estas imágenes paralelas visualizan todos los átomos de la superficie simultáneamente, ya que de otro modo no sería posible controlar la sincronización y desincronización de las oscilaciones.
Los nuevos conocimientos sobre la interacción de las facetas individuales de una nanopartícula pueden conducir ahora a catalizadores más eficaces y proporcionar conocimientos atómicos profundos sobre los mecanismos de la cinética de reacción no lineal, la formación de patrones y el acoplamiento espacial.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.






















































