Los investigadores miden la ruptura de un solo enlace químico
"Es una imagen increíble: poder ver realmente una pequeña molécula en una superficie con otra unida a ella es asombroso"
El equipo utilizó un microscopio de fuerza atómica (AFM) de alta resolución que funcionaba en un entorno controlado en el Centro de Imágenes y Análisis de Princeton. La sonda AFM, cuya punta termina en un solo átomo de cobre, se acercó gradualmente al enlace hierro-carbono hasta que se rompió. Los investigadores midieron las fuerzas mecánicas aplicadas en el momento de la ruptura, que eran visibles en una imagen captada por el microscopio. Un equipo de la Universidad de Princeton, la Universidad de Texas-Austin y ExxonMobil informó de los resultados en un artículo publicado el 24 de septiembre en Nature Communications.
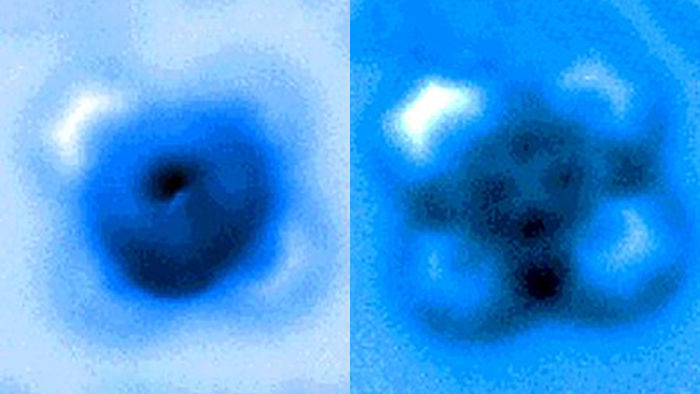
Los investigadores midieron las fuerzas mecánicas aplicadas para romper un enlace entre el monóxido de carbono y la ftalocianina de hierro, que aparece como una cruz simétrica en las imágenes del microscopio de sondeo tomadas antes y después de la ruptura del enlace.
Pengcheng Chen et al.
"Es una imagen increíble: poder ver una sola molécula pequeña en una superficie con otra unida a ella es asombroso", afirma el coautor Craig Arnold, catedrático de Ingeniería Mecánica y Aeroespacial Susan Dod Brown y director del Instituto de Ciencia y Tecnología de los Materiales de Princeton (PRISM).
"El hecho de que hayamos podido caracterizar ese enlace en particular, tanto tirando de él como empujándolo, nos permite entender mucho más la naturaleza de este tipo de enlaces -su fuerza, cómo interactúan- y esto tiene todo tipo de implicaciones, en particular para la catálisis, donde tienes una molécula en una superficie y luego algo interactúa con ella y hace que se rompa", dijo Arnold.
Nan Yao, investigador principal del estudio y director del Centro de Imágenes y Análisis de Princeton, señaló que los experimentos también revelaron cómo la ruptura de enlaces afecta a las interacciones de un catalizador con la superficie en la que está adsorbido. Mejorar el diseño de los catalizadores químicos tiene relevancia para la bioquímica, la ciencia de los materiales y las tecnologías energéticas, añadió Yao, que también es profesor de la práctica y becario principal de investigación en PRISM.
En los experimentos, el átomo de carbono formaba parte de una molécula de monóxido de carbono y el átomo de hierro procedía de la ftalocianina de hierro, un pigmento común y un catalizador químico. La ftalocianina de hierro está estructurada como una cruz simétrica, con un único átomo de hierro en el centro de un complejo de anillos conectados a base de nitrógeno y carbono. El átomo de hierro interactúa con el carbono del monóxido de carbono, y el hierro y el carbono comparten un par de electrones en un tipo de enlace covalente conocido como enlace dativo.
Yao y sus colegas utilizaron la punta de la sonda a escala atómica del instrumento AFM para romper el enlace hierro-carbono controlando con precisión la distancia entre la punta y las moléculas enlazadas, hasta incrementos de 5 picómetros (5 milmillonésimas de milímetro). La ruptura se produjo cuando la punta estaba a 30 picómetros por encima de las moléculas, una distancia que corresponde a una sexta parte de la anchura de un átomo de carbono. A esta altura, la mitad de la molécula de ftalocianina de hierro se volvió más borrosa en la imagen de AFM, indicando el punto de ruptura del enlace químico.
Los investigadores utilizaron un tipo de AFM conocido como de no contacto, en el que la punta del microscopio no entra en contacto directo con las moléculas estudiadas, sino que utiliza los cambios en la frecuencia de las vibraciones a escala fina para construir una imagen de la superficie de las moléculas.
Al medir estos cambios de frecuencia, los investigadores también pudieron calcular la fuerza necesaria para romper el enlace. Una punta de sonda de cobre estándar rompió el enlace hierro-carbono con una fuerza de atracción de 150 piconewtons. Con otra molécula de monóxido de carbono unida a la punta, el enlace se rompió con una fuerza de repulsión de 220 piconewtons. Para profundizar en la base de estas diferencias, el equipo utilizó métodos de simulación cuántica para modelar los cambios en las densidades de los electrones durante las reacciones químicas.
El trabajo aprovecha la tecnología AFM, avanzada por primera vez en 2009, para visualizar enlaces químicos individuales. La ruptura controlada de un enlace químico mediante un sistema de AFM ha sido más difícil que otros estudios similares sobre la formación de enlaces.
"Es un gran reto mejorar nuestra comprensión de cómo se pueden llevar a cabo las reacciones químicas mediante la manipulación de átomos, es decir, con una punta de un microscopio de sonda de barrido", afirma Leo Gross, que dirige el grupo de investigación Atom and Molecule Manipulation en IBM Research en Zúrich, y fue el autor principal del estudio de 2009 que resolvió por primera vez la estructura química de una molécula mediante AFM.
Al romper un enlace concreto con diferentes puntas que utilizan dos mecanismos distintos, el nuevo estudio contribuye a "mejorar nuestra comprensión y control de la ruptura de enlaces mediante la manipulación de átomos. Se añade a nuestra caja de herramientas para la química por manipulación de átomos y representa un paso adelante hacia la fabricación de moléculas diseñadas de creciente complejidad", añadió Gross, que no participó en el estudio.
Los experimentos son muy sensibles a las vibraciones externas y a otros factores de confusión. El instrumento especializado de AFM del Centro de Imágenes y Análisis se encuentra en un entorno de alto vacío, y los materiales se enfrían a una temperatura de 4 Kelvin, apenas unos grados por encima del cero absoluto, utilizando helio líquido. Estas condiciones controladas permiten realizar mediciones precisas, ya que garantizan que los estados energéticos y las interacciones de las moléculas sólo se ven afectados por las manipulaciones experimentales.
"Se necesita un sistema muy bueno y limpio porque esta reacción podría ser muy complicada: con tantos átomos implicados, no se puede saber qué enlace se rompe a una escala tan pequeña", explica Yao. "El diseño de este sistema simplificó todo el proceso y aclaró la incógnita de romper un enlace químico", dijo.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.