Níquel aniónico
El acoplamiento cruzado de éteres aromáticos catalizado por níquel procede a través de un anión níquelato
Los catalizadores metálicos se utilizan ampliamente en la producción de medicamentos, tintes, adhesivos y plásticos. Los investigadores han descubierto ahora una intrigante propiedad del níquel como catalizador: es capaz de catalizar el acoplamiento de hidrocarburos aromáticos en su forma aniónica, el ion níquelato. En esta forma, los dos metales, el litio y el níquel, trabajan en cooperación de forma única, explican los autores en la revista Angewandte Chemie.
© Wiley-VCH
Las estructuras basadas en el carbono tienen un gran número de usos, y suelen construirse utilizando catalizadores de paladio de metales preciosos. Una de las reacciones más extendidas para producir estas estructuras es el acoplamiento cruzado, en el que dos fragmentos de hidrocarburo se unen para crear una entidad más compleja. Sin embargo, algunos sustratos no pueden participar con éxito en la reacción, por lo que los químicos tienen que encontrar rutas alternativas o activar el sustrato para hacerlo compatible con estas reacciones de acoplamiento.
En algunos de estos escenarios, el níquel podría utilizarse como un catalizador alternativo abundante en tierra, escriben Eva Hevia y Andryj M. Borys, de la Universidad de Berna (Suiza). Ambos han demostrado que el níquel puede formar productos intermedios con carga negativa en determinadas condiciones. Estos productos intermedios pueden utilizarse para promover reacciones en sustratos que, de otro modo, serían difíciles de trabajar.
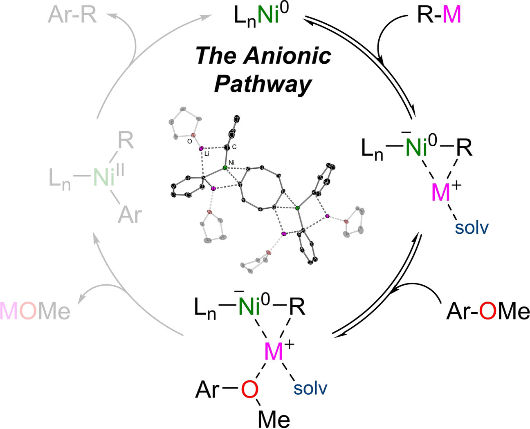
Por ejemplo, un catalizador de níquel es capaz de catalizar el acoplamiento cruzado de éteres de arilo, sustancias que se encuentran en el alquitrán y otros productos del petróleo crudo y que constituyen la base de una serie de productos químicos especializados. Estas sustancias tienen una reactividad muy limitada y suelen tener que ser activadas laboriosamente por los químicos antes de poder utilizarlas. Hevia y Borys investigaron la reacción del fenilitio, un benzol activado, con el éter metílico de beta-naftol, un éter arílico básico, utilizando un catalizador de níquel compuesto por un átomo de níquel y dos moléculas de ciclooctadieno, abreviado como Ni(COD)2.
Descubrieron que el ion cargado negativamente, o niquelato, se formaba en el primer paso de la reacción. Dos moléculas de fenilitio transfirieron su radical fenilo cargado negativamente al átomo neutro de níquel. Según los investigadores, esto sólo fue posible porque la estructura del níquelato intermedio estaba estabilizada tanto por los iones de litio cargados positivamente como por las moléculas de disolvente coordinadas.
A medida que avanzaba la reacción, el catalizador de níquelato iniciaba la escisión del desafiante enlace carbono-oxígeno en el sustrato de éter y su acoplamiento con uno de los fragmentos de fenilo, lo que hacía posible la formación del producto fenilnaftaleno. Hevia y Borys informan de que la reacción dependía en gran medida del disolvente utilizado, y que la cooperación entre el litio y el níquel era clave para su éxito.
Esta vía de reacción aniónica ofrece una alternativa atractiva a los acoplamientos cruzados estándar catalizados por paladio. El trabajo de Borys y Hevia ha revelado su dependencia de la formación y la estabilidad del catalizador utilizado. "Los conocimientos mecanísticos obtenidos gracias a este estudio deberían permitir nuevos desarrollos en las aplicaciones de la catálisis del níquel en la síntesis sostenible", afirma Hevia.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.



















































