Las bacterias que comen metano convierten el gas de efecto invernadero en combustible
Un método de vanguardia revela estructuras atómicas nunca vistas que controlan el proceso
Las bacterias metanotróficas consumen 30 millones de toneladas métricas de metano al año y han cautivado a los investigadores por su capacidad natural de convertir este potente gas de efecto invernadero en combustible utilizable. Sin embargo, sabemos muy poco sobre cómo se produce esta compleja reacción, lo que limita nuestra capacidad para aprovechar este doble beneficio.
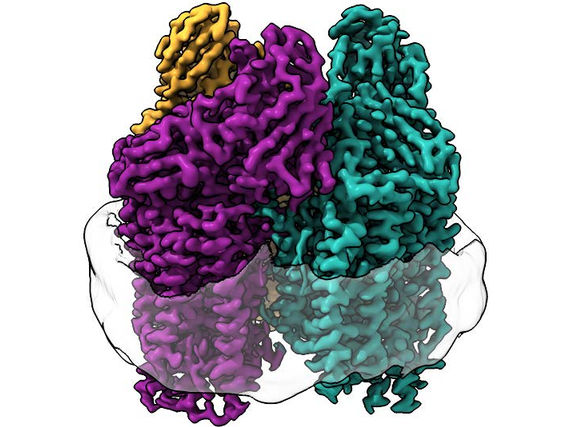
La crio-EM iluminó estructuras nunca antes vistas en la membrana de la proteína.
Northwestern University
Un equipo de la Universidad de Northwestern ha estudiado la enzima que utilizan las bacterias para catalizar la reacción y ha descubierto estructuras clave que podrían impulsar el proceso.
Sus hallazgos, que se publicarán el viernes (18 de marzo) en la revista Science, podrían conducir en última instancia al desarrollo de catalizadores biológicos fabricados por el ser humano que conviertan el gas metano en metanol.
"El metano tiene un enlace muy fuerte, por lo que es bastante sorprendente que haya una enzima que pueda hacer esto", dijo Amy Rosenzweig, de Northwestern, autora principal del artículo. "Si no entendemos exactamente cómo la enzima lleva a cabo esta difícil química, no vamos a ser capaces de diseñarla y optimizarla para aplicaciones biotecnológicas".
Rosenzweig es catedrática distinguida por la familia Weinberg de Ciencias de la Vida en el Colegio Weinberg de Artes y Ciencias de Northwestern, donde tiene nombramientos tanto en biociencias moleculares como en química.
La enzima, denominada monooxigenasa de metano en partículas (pMMO), es una proteína especialmente difícil de estudiar porque está incrustada en la membrana celular de las bacterias.
Normalmente, cuando los investigadores estudian estas bacterias metanotróficas, utilizan un proceso duro en el que las proteínas son arrancadas de las membranas celulares utilizando una solución detergente. Aunque este procedimiento aísla eficazmente la enzima, también mata toda la actividad enzimática y limita la cantidad de información que los investigadores pueden recopilar, como si se tratara de monitorizar un corazón sin el latido.
En este estudio, el equipo utilizó una técnica totalmente nueva. Christopher Koo, primer autor y candidato al doctorado en el laboratorio de Rosenzweig, se preguntó si poniendo la enzima de nuevo en una membrana que se asemejara a su entorno nativo, podrían aprender algo nuevo. Koo utilizó lípidos de la bacteria para formar una membrana dentro de una partícula protectora llamada nanodisco, y luego incrustó la enzima en esa membrana.
"Al recrear el entorno nativo de la enzima dentro del nanodisco, pudimos restaurar la actividad de la enzima", dijo Koo. "Luego, pudimos utilizar técnicas estructurales para determinar a nivel atómico cómo la bicapa lipídica restablecía la actividad. Al hacerlo, descubrimos la disposición completa del sitio de cobre en la enzima donde probablemente se produce la oxidación del metano".
Los investigadores utilizaron la criomicroscopía electrónica (crio-EM), una técnica muy adecuada para las proteínas de membrana porque el entorno de la membrana lipídica no se ve alterado durante todo el experimento. Esto les permitió visualizar por primera vez la estructura atómica de la enzima activa a alta resolución.
"Como consecuencia de la reciente 'revolución de la resolución' en la crio-EM, pudimos ver la estructura con detalle atómico", dijo Rosenzweig. "Lo que vimos cambió por completo la forma en que pensábamos sobre el sitio activo de esta enzima".
Rosenzweig dijo que las estructuras criogénicas proporcionan un nuevo punto de partida para responder a las preguntas que se siguen acumulando. ¿Cómo viaja el metano hasta el sitio activo de la enzima? ¿O el metanol sale de la enzima? ¿Cómo realiza el cobre en el sitio activo la reacción química? A continuación, el equipo tiene previsto estudiar la enzima directamente en el interior de la célula bacteriana mediante una técnica de imagen de vanguardia denominada criotomografía de electrones (cryo-ET).
Si tienen éxito, los investigadores podrán ver exactamente cómo está dispuesta la enzima en la membrana celular, determinar cómo funciona en su entorno verdaderamente nativo y saber si otras proteínas que rodean a la enzima interactúan con ella. Estos descubrimientos proporcionarían un eslabón clave que falta a los ingenieros.
"Si se quiere optimizar la enzima para incorporarla a vías de biofabricación o para que consuma contaminantes distintos del metano, hay que saber cómo es en su entorno nativo y dónde se une el metano", dijo Rosenzweig. "Se podrían utilizar bacterias con una enzima manipulada para recoger el metano de los lugares de fracturación o para limpiar los vertidos de petróleo".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.























































