"Clics" de moléculas inestables con estrategia sintética
Los elementos de la tabla periódica de los elementos se enumeran de forma que se enfatizan ciertas relaciones. Hay familias, períodos (las filas horizontales) y grupos (las columnas verticales). Los elementos dentro de cada una de estas agrupaciones presentan algunos puntos en común.
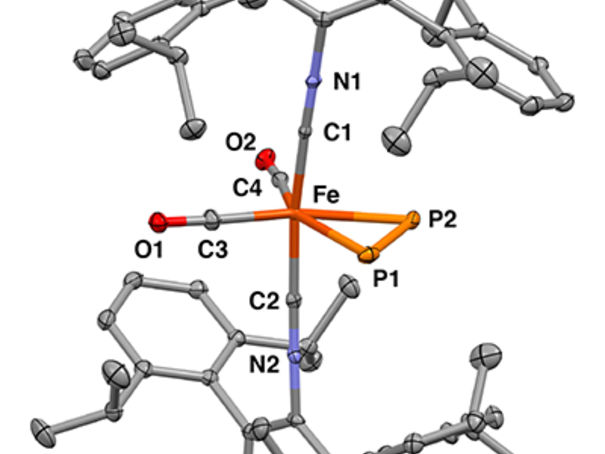
Estructura cristalina de rayos X del complejo mononuclear de hierro η2-difósforo
Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University
Las relaciones diagonales en la tabla periódica existen entre dos elementos en posiciones diagonales entre sí que presentan propiedades químicas similares. El litio y el magnesio, el boro y el silicio, y el carbono y el fósforo son todos ejemplos.
Desde hace mucho tiempo se reconoce una relación diagonal icónica entre el carbono y el fósforo, especialmente en los casos en los que hay enlaces múltiples elemento-elemento, como el difósforo (P2) en el que dos átomos de fósforo están unidos por un triple enlace débil.
Esta relación diagonal entre el fósforo y el carbono ha creado la expectativa de que la molécula de difósforo debe imitar los atributos del hidrocarburo acetileno (C2H2). Por ejemplo, tanto el difósforo como el acetileno reaccionan con otras moléculas orgánicas a través de sus enlaces pi, un tipo de enlace covalente que se encuentra en las moléculas con enlaces múltiples.
Un complejo de coordinación consta de un átomo o ion central que suele ser metálico y está rodeado de moléculas o iones unidos, conocidos como ligandos o agentes complejantes. Los complejos de coordinación son vitales para la vida en la Tierra e incluyen la hemoglobina y la clorofila. También se utilizan mucho en aplicaciones industriales como catalizadores.
Aunque el acetileno tiene una química de coordinación bien documentada con metales de transición simples, los complejos de coordinación que presentan difósforo unido a un solo centro metálico han permanecido esquivos.
Recientemente, investigadores de la Universidad de California en San Diego, la Universidad de Rochester y la Universidad Estatal de Ohio han informado de la unión del difósforo a un único centro metálico. Este trabajo aparece en el número del 25 de marzo de Science.
El difósforo, a diferencia del acetileno, es muy inestable y reactivo. Cuando se genera en forma libre, el difósforo se polimeriza rápidamente o reacciona con las moléculas de sustrato presentes. En otras palabras, el difósforo no permanece como tal durante mucho tiempo: su naturaleza es combinarse con otros elementos y moléculas. Esto hace que sea difícil de estudiar o manipular.
Se han establecido varias rutas sintéticas para formar complejos multinucleares de difósforo. El método más popular es la separación de la molécula tetraédrica P4, más conocida como fósforo blanco. Sin embargo, el fósforo blanco es tóxico y altamente inflamable (fue uno de los principales componentes de muchas bombas incendiarias utilizadas en la Segunda Guerra Mundial).
"El trabajo presentado aquí proporciona una estrategia sintética para acceder a complejos mononucleares de difósforo en el laboratorio", declaró el profesor de Química y Bioquímica de la UC San Diego Joshua Figueroa, investigador principal y coautor del trabajo. "Anticipamos que este modo de coordinación puede permitir el desarrollo de reacciones selectivas de transferencia de átomos de fósforo a moléculas orgánicas".
Al diseñar el experimento, Figueroa y el becario postdoctoral de la UC San Diego Shuai Wang utilizaron el hierro como ion metálico porque proporcionaba una buena plataforma de coordinación que permitía la unión de pequeñas moléculas de forma eficiente. Al unir el difósforo a un ion de hierro, pudieron unir los dos átomos de fósforo de forma que se evitara la liberación libre del difósforo, proporcionando la tan buscada estabilidad.
Wang, que es el primer autor del artículo y realizó el trabajo de síntesis, dijo: "Teniendo en cuenta la extrema sensibilidad de la molécula de difósforo libre como especie fugaz, es notable la estabilidad que adquiere al coordinarse con el centro de hierro mononuclear estéricamente obstaculizado".
Los investigadores utilizaron la cristalografía de rayos X para determinar la estructura tridimensional precisa de las moléculas y la espectroscopia Mossbauer para observar los cambios en las interacciones de enlace entre el ion de hierro y el difósforo. Esta técnica fue clave porque permitió a los investigadores demostrar que el difósforo y una molécula de acetileno influían en las propiedades del centro de hierro de forma similar.
Si el difósforo puede existir en una forma relativamente estable y selectivamente reactiva, los científicos podrán unirlo a sustratos en algo conocido como química "click". La química del clic no describe una reacción única y específica, sino una forma de generar sustancias mediante la unión de pequeñas unidades modulares. Esto puede abrir nuevas áreas de descubrimiento en la química sintética para la preparación de compuestos farmacéuticos.
"Estamos entusiasmados con este trabajo porque demuestra la importancia de utilizar los conceptos fundamentales aprendidos en el primer año de química para guiar los nuevos descubrimientos", dijo Figueroa.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.