Cómo un aditivo común da impulso a las baterías de iones de litio
Los investigadores han identificado lo que hace que un aditivo de electrolito común sea tan eficaz para mejorar el rendimiento de las baterías que utilizan un cátodo de óxido de cobalto de litio
Los nitrilos -un compuesto orgánico con un átomo de carbono triplemente unido a un átomo de nitrógeno- se añaden habitualmente a la fórmula del electrolito de las baterías que utilizan un cátodo de óxido de cobalto y litio, lo que hace que estas baterías estén mucho más cerca de alcanzar su pleno rendimiento teórico. Hasta ahora, los investigadores de baterías no habían entendido realmente por qué estos nitrilos funcionan de esta manera. Pero un grupo de electroquímicos ha utilizado técnicas avanzadas de microscopía para observar más de cerca lo que ocurre a escala molecular y ha identificado lo que sucede, abriendo nuevas vías para mejorar aún más el rendimiento de las baterías.

Los investigadores identifican cómo un aditivo común da impulso a las baterías de iones de litio (imagen simbólica).
Computer generated picture
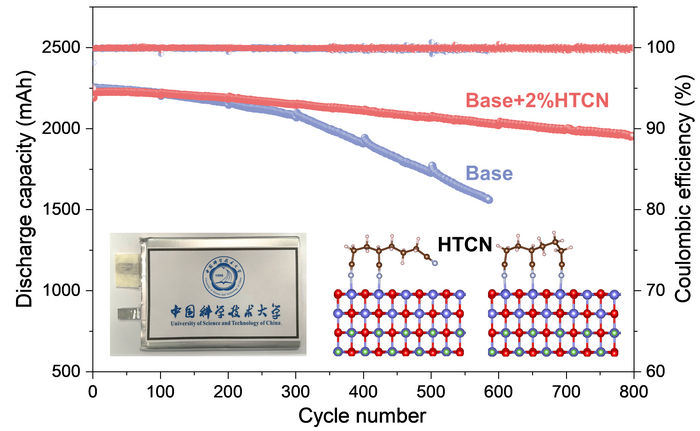
Se ha estudiado de forma exhaustiva el rendimiento electroquímico y el mecanismo de trabajo del aditivo HTCN en el cátodo de LiCoO2 de alto voltaje para las células de bolsa prácticas.
Nano Research

El estudio se publicó en la revista Nanoinvestigación el 22 de septiembre de 2022.
El óxido de cobalto y litio (LiCoO2, o simplemente "LCO") es el material más utilizado para los cátodos -los electrodos positivos- de las baterías de iones de litio. Esto es especialmente cierto en el caso de las baterías utilizadas en dispositivos electrónicos portátiles, gracias a la alta tensión de funcionamiento del LCO, su gran capacidad y la estabilidad de su rendimiento a largo plazo.
Pero lo que ha hecho que los cátodos de LCO sean especialmente atractivos es que ofrecen más energía para una menor cantidad de espacio (mayor densidad de energía), lo que resulta muy útil para dispositivos de consumo más pequeños, como teléfonos, smartwatches, y aparatos que tienen limitaciones de espacio aún más estrictas, como los sensores inteligentes domésticos e industriales.
Sin embargo, por el momento, los cátodos LCO sólo pueden ofrecer aproximadamente la mitad de su capacidad específica teórica. En pocas palabras, esto significa que lo que realmente entregan es mucho menos de lo que teóricamente deberían ser capaces de producir. Por eso, a menudo tienen dificultades para satisfacer las crecientes demandas de densidad energética de la electrónica portátil.
Una forma de salvar este obstáculo sería aumentar la tensión de carga limitada de las baterías que utilizan cátodos LCO. La tensión de carga limitada describe el punto en el que se considera que una batería está completamente cargada. Más allá de este punto, la batería podría resultar dañada, por lo que muchos dispositivos simplemente se apagan cuando se alcanza el umbral de corte. Este umbral se establece de forma un tanto arbitraria, por lo que podría aumentarse, y este funcionamiento a alto voltaje resulta prometedor para dar un impulso a la densidad energética de este tipo de baterías.
Pero aquí surge un nuevo problema: el funcionamiento a alta tensión puede exacerbar las reacciones químicas perjudiciales en la interfaz entre el cátodo y el electrolito. Esto puede provocar grietas y otros daños internos, que a su vez pueden deteriorar aún más la interfaz entre los electrodos. En última instancia, todo esto puede dar lugar a una disminución radical de la capacidad de la batería y a un fuerte aumento de los problemas de seguridad. La temperatura de funcionamiento de estos dispositivos puede alcanzar los 45℃ debido a su propia generación de calor, lo que acorta aún más la vida de la batería.
Por eso, desde hace algún tiempo, la mezcla de compuestos adicionales en la fórmula del electrolito para modificar la actividad de reacción del mismo (el medio que contiene iones y que ayuda a establecer una corriente mediante el movimiento de iones positivos y negativos a través de él) en la interfaz entre el cátodo y el electrolito ha demostrado ser una estrategia muy eficaz para disminuir la actividad de reacción del electrolito.
Hay una serie de compuestos diferentes que se utilizan como aditivos de electrolitos, pero para las baterías de iones de litio, los nitrilos son quizás los más utilizados. Los nitrilos son cualquier compuesto orgánico que tiene una sección de la molécula (un "grupo funcional") formada por un átomo de carbono triplemente unido a un átomo de nitrógeno.
Sin embargo, el mecanismo de funcionamiento de los aditivos de nitrilo en los cátodos de alto voltaje todavía no se conoce del todo, sobre todo en el tipo de baterías de bolsa LCO de alto voltaje que se utilizan en la práctica. (Las baterías de petaca son un tipo de batería "blanda" sin carcasa metálica dura, cuyos componentes están encerrados en una película de plástico recubierta de aluminio, con un aspecto similar al de una "petaca" de chicle o tabaco suelto. Desarrolladas por primera vez en 1995 y permitiendo un uso mucho más eficiente del espacio, las baterías de bolsa se han convertido desde entonces en una opción común para los fabricantes debido a esta ventaja de diseño).
Hay dos teorías principales que intentan explicar el mecanismo de los aditivos de nitrilo, pero ambas tienen importantes deficiencias en su poder explicativo.
"Los nitrilos funcionan bien, pero no sabemos realmente por qué funcionan bien, por qué se produce esta acción estabilizadora. Lo que ocurre exactamente sigue siendo bastante misterioso", afirma Shuhong Jiao, electroquímico de la Universidad de Ciencia y Tecnología de China (USTC). "Y si no sabemos por qué funciona lo que estamos haciendo para mejorar las baterías, esto nos impide afinar nuestros esfuerzos para mejorar aún más las cosas".
Así que los investigadores tomaron un aditivo electrolítico de nitrilo común, el ligando tridentado que contiene 1,3,6-hexanetricarbonitrilo (o, más sencillamente, HTCN) para tratar de arrojar luz sobre cuál es el mecanismo de los nitrilos en la estabilización de alto voltaje de un cátodo de LiCoO2.
Mientras la batería funcionaba, y superaba con creces a una equivalente sin los aditivos del electrolito HTCN, los investigadores utilizaron la microscopía electrónica para ver de cerca lo que ocurría, combinada con un análisis de la composición iónica y elemental del sistema. Comprobaron que el aditivo HTCN inhibía muy eficazmente la generación de grietas y la disolución de los iones de cobalto.
A continuación, utilizando la espectroscopia de fotoelectrones de rayos X combinada con una serie de cálculos teóricos, descubrieron que las moléculas de HTCN se adsorbían eficazmente en (se pegaban a) la superficie del LCO y se incrustaban en la interfaz entre el cátodo y el electrolito, lo que a su vez inhibía en gran medida una reacción de oxidación en la superficie del LCO, impidiendo así una descomposición continua del electrolito.
En conjunto, esto equivale a una interfaz mucho más estable entre el cátodo y el electrolito, que suprime significativamente la descomposición de los componentes y la formación de grietas. Esta estructura estable y densa del cátodo y el electrolito es la que mejora la estabilidad de la batería a lo largo de muchos ciclos de carga y descarga.
Al conocer esta comprensión a nivel molecular de cómo los aditivos de nitrilo dan un impulso a estas baterías, los investigadores pueden ahora buscar otras formulaciones de aditivos para electrolitos que produzcan una estructura de interfaz similar o mejor.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.






















































