Transformaciones microscópicas de las superficies de los electrocatalizadores
Los investigadores revelan el desorden de las superficies de cobre durante la catálisis
Anuncios
El desarrollo de tecnologías capaces de convertirel CO2 en combustibles sintéticos y productos químicos básicos es de vital importancia para alcanzar los objetivos climáticos. La reducción electroquímica delCO2 en electrodos de cobre permite hacerlo directamente con energía eléctrica procedente de fuentes renovables que podría utilizarse para la producción de e-combustibles. Nuevos estudios demuestran que este proceso cambia la disposición de los átomos de cobre en la superficie del catalizador.
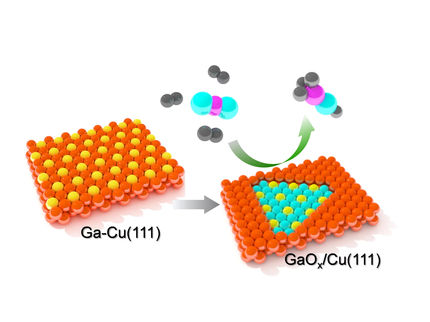
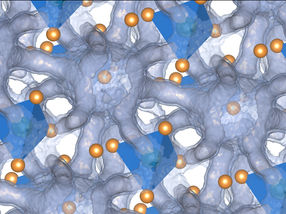
El cobre es un material catalizador indispensable para la reducción delCO2, especialmente para la síntesis de determinados productos químicos y combustibles valiosos, como el etanol. Para ello, es muy favorable que los átomos de cobre de la superficie tengan una disposición fuertemente desordenada. Esto último puede lograrse, por ejemplo, preoxidando la superficie de cobre o mediante aleación. En un estudio conjunto del Instituto de Física Experimental y Aplicada de la Universidad de Kiel y el Departamento de Ciencia de las Interfaces del Instituto Fritz Haber (FHI) de la Sociedad Max Planck (MPG), se descubrió que estas estructuras desordenadas también se forman espontáneamente en las fases iniciales de la reacción electrocatalítica de reducción deCO2. Los investigadores observaron que los átomos de cobre del interior del metal se desplazaban hacia la superficie y se ensamblaban formando un grupo independiente de unos pocos átomos. Esta transformación del metal fue provocada por el CO, un producto intermedio de la reacción, y se mantuvo incluso a altas velocidades de reacción. Los resultados se publican hoy en la prestigiosa revista científica Nature Catalysis.
"Dado que la reducción electrocatalíticadel CO2 se produce en metales en una solución acuosa de carbonatos similar al agua mineral, y va acompañada de la formación de gas hidrógeno, resulta difícil realizar investigaciones detalladas del proceso a escala atómica", afirma Olaf Magnussen, catedrático de Física del Estado Sólido de la Universidad de Kiel.
Por ello, los investigadores utilizaron una combinación de métodos que pueden emplearse incluso en estas difíciles condiciones. El equipo de Kiel observó directamente la transformación de la superficie de cobre mediante microscopía electroquímica de barrido en túnel de alta resolución. Este método permite obtener imágenes directas de los átomos y moléculas de la superficie. Los estudios de difracción de rayos X, realizados por científicos de Kiel y Berlín en el sincrotrón PETRA III del DESY de Hamburgo, confirmaron esta transformación. Además, estas mediciones mostraron que a altas velocidades de reacción los átomos de cobre libres se mantenían, pero no se producía ninguna otra formación. La espectroscopia molecular del Instituto Fritz Haber indicó finalmente que los cambios estaban inducidos por el CO formado.
"Los resultados sugieren una drástica transformación de la superficie del electrodo cada vez que se activa el potencial eléctrico necesario para la reduccióndel CO2. Esto era desconocido hasta ahora, pero podría desempeñar un papel importante en la catálisis", afirma la profesora Beatriz Roldán Cuenya, Directora del Departamento de Ciencias de la Interfaz del FHI. Una estrategia para influir en la estructura del catalizador y, por tanto, en el tipo de compuestos químicos formados consiste en hacer funcionar el electrodo con impulsos de tensión. De hecho, esto ya se había demostrado en trabajos anteriores del equipo de investigación. Sin embargo, el cobre allí presente se oxidaba periódicamente mediante energía eléctrica, lo que requiere invertir la polaridad del electrodo. Según los nuevos resultados, podrían obtenerse efectos similares simplemente conectando y desconectando la corriente. "En conjunto, el estudio confirma nuestra hipótesis de que no sólo el material del electrodo, sino también las condiciones de funcionamiento y el microentorno son relevantes para la realización de esta tecnología respetuosa con el medio ambiente", afirma el equipo.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.