La imagen de los átomos más pequeños permite comprender la inusual bioquímica de una enzima
Esto podría ayudar a diseñar enzimas para la industria química
Cuando sus heridas cicatrizan y su hígado desintoxica un veneno como la histamina que ha ingerido, puede agradecer su ayuda a la clase de enzimas conocidas como amina oxidasas de cobre. Identificar las posiciones exactas de los átomos de hidrógeno más pequeños en estas enzimas es un reto con las tecnologías utilizadas habitualmente, pero es fundamental para diseñar enzimas mejoradas que presenten una reactividad bioquímica inusual pero útil.
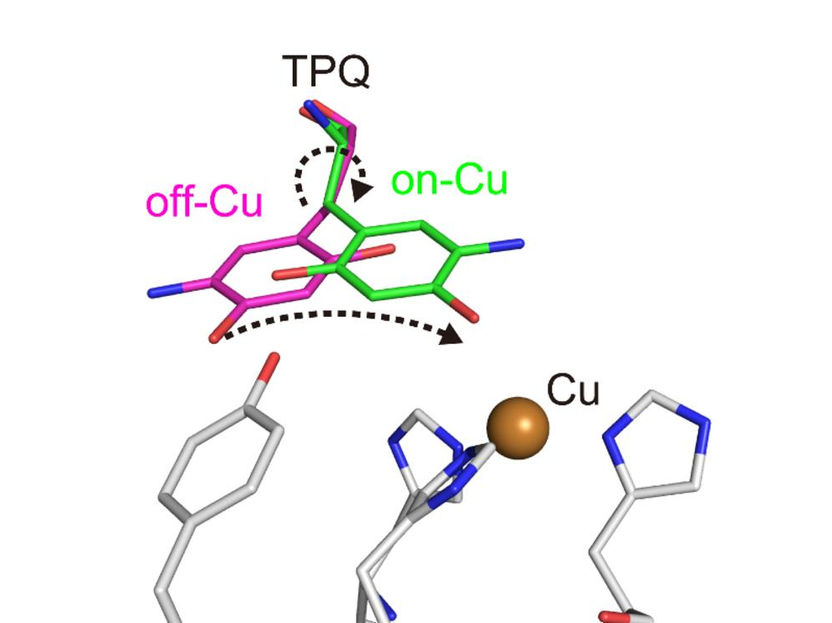
Cambio conformacional del cofactor TPQ durante la catálisis. TPQ emprende un cambio conformacional de off-Cu a on-Cu de manera que genera un intermediario radical semiquinona.
Takeshi Murakawa, Toshihide Okajima
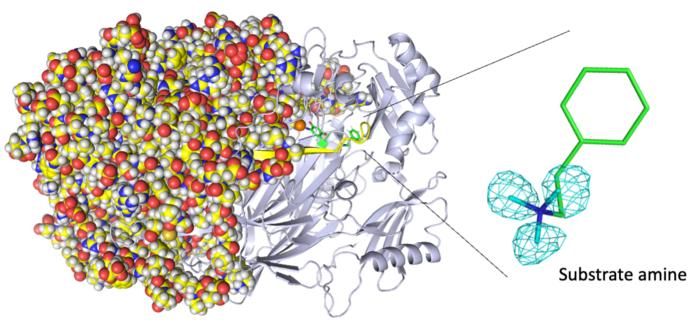
Estructura cristalina neutrónica completa de la amina oxidasa de cobre. (Izquierda) La cristalografía de neutrones determinó la estructura completa de la proteína, incluidos los átomos de hidrógeno. (Derecha) Las posiciones precisas de los átomos de hidrógeno indican que la molécula detectada no es un aldehído producto, sino una amina sustrato. Los mapas de los átomos de hidrógeno (más concretamente, de deuterio) se presentan utilizando una malla cian.
Takeshi Murakawa, Toshihide Okajima
Ahora, en un estudio publicado recientemente en ACS Catalysis, un equipo dirigido por investigadores de la Universidad Médica y Farmacéutica de Osaka y de la Universidad de Osaka ha utilizado la cristalografía de neutrones para obtener imágenes de la estructura átomo por átomo de una enzima amina oxidasa de cobre. Este estudio proporciona una visión estructural sin precedentes de la bioquímica de la enzima.
Algunas enzimas amino oxidasas de cobre presentan una bioquímica inusual, como el efecto túnel cuántico, que permite velocidades de reacción inexplicablemente rápidas. Aunque a menudo es difícil determinar la posición exacta de cada átomo de hidrógeno en la enzima, este conocimiento es importante para diseñar las enzimas artificiales correspondientes. Los investigadores suelen obtener la estructura de las enzimas átomo por átomo mediante cristalografía de rayos X. Sin embargo, esta técnica permite obtener información estructural sobre la enzima. Sin embargo, esta técnica obtiene la información estructural por difracción de electrones en la enzima. Por tanto, es insuficiente para obtener imágenes de átomos de hidrógeno, que suelen contener un solo electrón. La cristalografía de neutrones, que analiza la difracción de los núcleos atómicos de la enzima (todos los átomos tienen un núcleo atómico), es una técnica de imagen alternativa que los investigadores eligieron para su trabajo.
"Hay cuestiones relacionadas con la dependencia del pH, el cambio conformacional y la estabilización radical intermedia de nuestra enzima que la cristalografía de rayos X por sí sola no puede explicar del todo", explica Takeshi Murakawa, autor principal del estudio. "La cristalografía de neutrones es muy adecuada para responder a estas preguntas".
Los investigadores obtuvieron numerosos datos. Por ejemplo, obtuvieron imágenes del estado de protonación/desprotonación (relacionado con el pH) de lugares de la enzima que son importantes para estabilizar especies radicales (es decir, átomos especialmente reactivos que contienen un electrón no apareado). También caracterizaron los movimientos del cofactor topaquinona de la enzima -deslizamiento, inclinación hacia arriba y media rotación- que facilitan la transferencia de un solo electrón dentro de la enzima.
"Revelamos la unión de una segunda molécula de sustrato amínico de alta afinidad durante la reacción enzimática, un acontecimiento desconocido hasta ahora en el sitio activo de la enzima", afirma Toshihide Okajima, autor principal. "La cristalografía de rayos X pasa por alto este tipo de descubrimientos".
Este trabajo ha proporcionado detalles estructurales hasta ahora desconocidos en una enzima amina oxidasa de cobre que tiene muchas funciones en el metabolismo bioquímico. Revelar la posición exacta de los átomos de hidrógeno en la enzima ayuda a explicar su eficacia a temperaturas y presiones fisiológicas. En el futuro, los investigadores podrían aplicar estos conocimientos al diseño de enzimas artificiales que funcionen en la industria química.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Takeshi Murakawa, Kazuo Kurihara, Mitsuo Shoji, Naomine Yano, Katsuhiro Kusaka, Yoshiaki Kawano, Mamoru Suzuki, Yasuteru Shigeta, Takato Yano, Motoyasu Adachi, Katsuyuki Tanizawa, Toshihide Okajima; "Neutron Crystallography of a Semiquinone Radical Intermediate of Copper Amine Oxidase Reveals a Substrate-Assisted Conformational Change of the Peptidyl Quinone Cofactor"; ACS Catalysis, Volume 13, 2023-9-7





















































