Una nueva reacción del amoníaco podría ser una fuente sostenible de nitrógeno
Nuevo sistema de activación y transferencia catalítica del amoníaco - catálisis basada en elementos del grupo principal
Uno de los principales objetivos de la química es producir aminas a partir de amoníaco e hidrocarburos insaturados de forma sencilla. Además, durante la adición catalítica, en la que el amoníaco se activa y luego se transfiere, no se producen residuos, por lo que resulta especialmente sostenible. Investigadores del Instituto de Tecnología de Karlsruhe (KIT) han dado un paso más hacia la consecución de este objetivo. Han desarrollado un sistema para la activación y transferencia catalítica del amoníaco que no se basa en metales de transición, sino en un compuesto de elementos del grupo principal.
La molécula de amoníaco (NH3), un compuesto de nitrógeno e hidrógeno, es una de las sustancias químicas más producidas en todo el mundo y constituye el material de partida para la producción de muchos otros compuestos que contienen nitrógeno. Si fuera posible producir aminas simplemente añadiendo amoníaco a hidrocarburos insaturados, la química habría realizado un avance decisivo. Y es que las aminas, derivados orgánicos del amoníaco, son muy demandadas en muchos ámbitos: sirven, por ejemplo, como componentes básicos para productos agroquímicos y farmacéuticos, así como para sustancias activas de lavado, tintes, lubricantes y revestimientos. Las aminas también se utilizan como catalizadores en la producción de poliuretanos. Otra aplicación importante es la depuración de gases en refinerías y centrales eléctricas.
Al romper el fuerte enlace entre el nitrógeno y el hidrógeno, conocido como activación, la molécula de amoníaco puede, al menos en teoría, transferirse a otras moléculas como los hidrocarburos insaturados. Por ejemplo, la transferencia de amoníaco al alqueno etileno, una sustancia importante en la industria química, produciría etilamina. Los químicos denominan a esta adición hidroaminación. Sin embargo, el amoníaco y el etileno no reaccionan entre sí sin más: un catalizador debe mediar en la reacción. Sin embargo, los catalizadores habituales y los basados en metales de transición tienen el inconveniente de que ellos mismos reaccionan con el amoníaco y, por tanto, se vuelven inactivos. "Por ello, la hidroaminación de alquenos no activados con amoníaco se considera un gran reto, el Santo Grial de la catálisis, por así decirlo", explica el profesor Frank Breher, jefe del grupo de investigación del Departamento de Química Molecular del Instituto de Química Inorgánica (AOC) del KIT.
Activación y transferencia catalítica del amoníaco
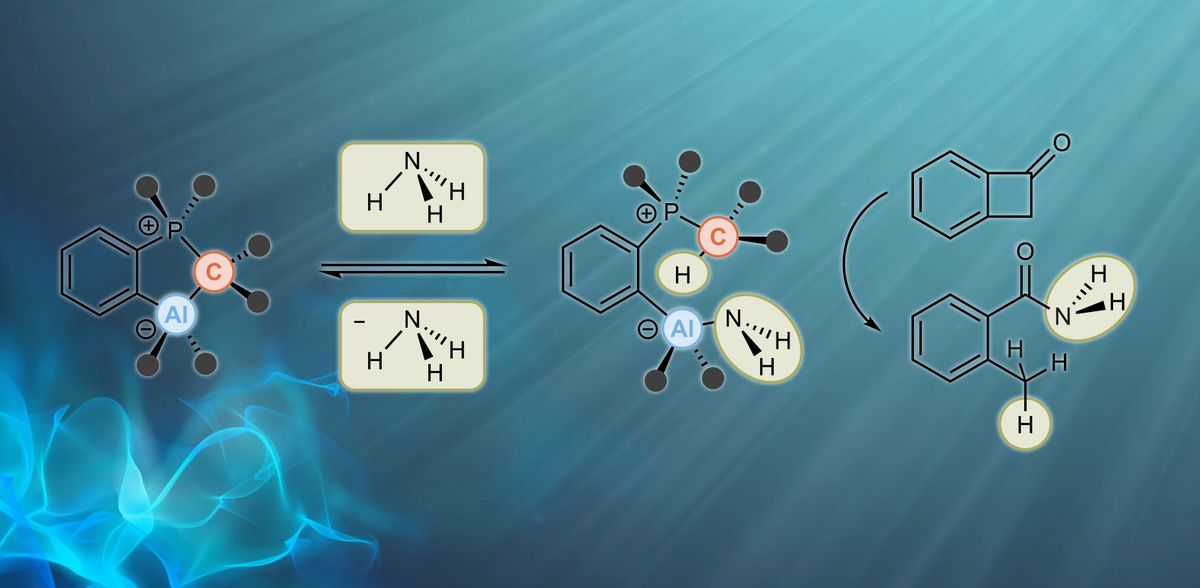
El profesor Frank Breher y el Dr. Felix Krämer del AOC del KIT, con el apoyo de investigadores de la Universidad de Paderborn y de la Universidad Complutense de Madrid, están ahora mucho más cerca de alcanzar este difícil objetivo. "Hemos desarrollado un sistema para activar el amoníaco que no se basa en metales de transición, sino en elementos del grupo principal. Durante el proceso 'atómico-económico' de activación y la posterior transferencia de amoníaco no se producen residuos, lo que resulta especialmente interesante desde el punto de vista de la sostenibilidad", afirma Breher. Los investigadores informan ahora de su trabajo en la revista Nature Chemistry.
El equipo creó el llamado par de Lewis frustrado (FLP), formado por un ácido como aceptor de pares de electrones y una base como donante de pares de electrones. Ambos suelen reaccionar entre sí y producir un aducto. Si se impide o al menos se limita la formación de aductos, se produce una situación frustrada, por así decirlo, y la molécula reacciona fácilmente con moléculas pequeñas como el amoníaco. "Sin embargo, es crucial amortiguar la reactividad de tal manera que la reacción con moléculas pequeñas sea lo más reversible posible, porque sólo entonces es posible utilizar también un FLP de este tipo en catálisis. Lo hemos conseguido por primera vez con amoníaco como sustrato", informa Breher. Los investigadores demostraron que el compuesto del título reacciona fácilmente con amoníaco no acuoso de forma termoneutral y rompe reversiblemente el enlace nitrógeno-hidrógeno del amoníaco a temperatura ambiente. Además, en su publicación presentan por primera vez reacciones de transferencia de NH3 mediadas por un catalizador basado en elementos del grupo principal. "Aunque hasta ahora sólo hemos convertido sustratos activados y aún no hidrocarburos insaturados, nos hemos acercado significativamente a la 'reacción soñada'", afirma Breher. "Esperamos que nuestra primera prueba de principio impulse nuevos trabajos sobre el uso del amoníaco activado con N-H como fuente de nitrógeno fácilmente disponible y sostenible".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Alemán se puede encontrar aquí.