Complejo molecular de manganeso como superfotooxidante
Científicos desarrollan un nuevo sistema molecular a partir del abundante elemento manganeso para fotooxidaciones
Los fotocatalizadores altamente reductores u oxidantes constituyen un reto fundamental en fotoquímica. Hasta ahora, sólo unos pocos complejos de metales de transición con iones metálicos abundantes en la Tierra se han convertido en oxidantes de estado excitado, como el cromo, el hierro y el cobalto. Todos estos fotocatalizadores requieren luz de alta energía para su excitación y su poder oxidante aún no se ha explotado plenamente. Además, en la mayoría de los casos los ingredientes decisivos son metales preciosos y, por tanto, caros. Un equipo de investigadores dirigido por la profesora Katja Heinze, de la Universidad Johannes Gutenberg de Maguncia (JGU), ha desarrollado ahora un nuevo sistema molecular basado en el elemento manganeso. El manganeso, a diferencia de los metales preciosos, es el tercer metal más abundante después del hierro y el titanio y, por tanto, ampliamente disponible y muy barato.
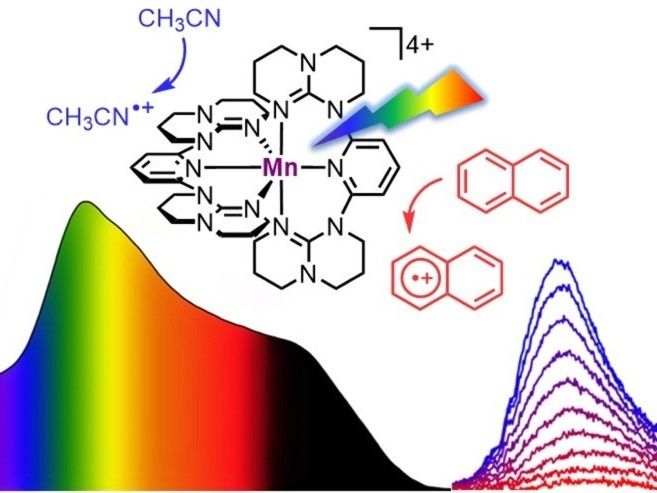
Desafiantes fotooxidaciones mediante el "Braunstein molecular" y la luz
©: Katja Heinze / JGU
Comportamiento inusual del "Braunstein molecular"
El equipo de la profesora Katja Heinze ha diseñado un complejo soluble de manganeso que absorbe toda la luz visible del azul al rojo, es decir, en una longitud de onda de 400 a 700 nanómetros, y partes de la luz infrarroja cercana de hasta 850 nanómetros. Esta absorción pancromática del complejo recuerda al color oscuro del Braunstein o dióxido de manganeso, que es un mineral natural. A diferencia del Braunstein mineral, el nuevo "Braunstein molecular" emite luz NIR-II con una longitud de onda de 1.435 nanómetros tras su excitación con luz visible o NIR-I con una longitud de onda de 850 nanómetros. "Se trata de una observación inusual para un sistema molecular basado en el manganeso en su estado de oxidación +IV. Incluso en el caso de los metales nobles, la emisión en esta región energética no tiene precedentes", afirma la profesora Katja Heinze.
Aún más intrigante que esta luminiscencia NIR-II de un sistema molecular de manganeso es la observación de que, tras la fotoexcitación, el "Braunstein molecular" puede oxidar diversos sustratos orgánicos. Esto incluye moléculas aromáticas extremadamente difíciles con potenciales de oxidación muy elevados, como naftaleno, tolueno o benceno. "Incluso disolventes muy estables pueden ser atacados por el superfotooxidante cuando se excitan con luz LED", subraya el Dr. Nathan East, que preparó el nuevo complejo y realizó todos los experimentos de fotólisis durante su doctorado en el grupo de la profesora Katja Heinze.
Observación de dos estados fotoactivos gracias a la espectroscopia ultrarrápida
Las técnicas espectroscópicas ultrarrápidas que utilizan pulsos láser con una resolución temporal de subpicosegundos revelaron una reactividad inusual de los estados excitados y dos estados fotoactivos diferentes: un estado de alta energía muy efímero pero extremadamente oxidante y un estado de baja energía moderadamente oxidante de vida más larga. El primero puede atacar moléculas de disolvente que ya están cerca del complejo antes de la excitación luminosa, mientras que el segundo estado excitado existe el tiempo suficiente para atacar sustratos aromáticos tras la colisión difusional. "Esto se denomina apagado estático y dinámico de los estados excitados", explicó el Dr. Robert Naumann, científico especializado en espectroscopia de resolución temporal del grupo de la Profesora Katja Heinze.
Cálculos de química cuántica para comprender fotoprocesos inusuales
"Cuando modelamos los estados excitados implicados mediante cálculos de química cuántica a la luz de los resultados espectroscópicos, obtuvimos una imagen detallada de los procesos fotoinducidos", añadió Heinze. "Estos cálculos avanzados y laboriosos sólo fueron posibles gracias a la potencia de cálculo de los superordenadores MOGON y ELWETRITSCH de Renania-Palatinado", explicó el Dr. Christoph Förster, científico del grupo de Katja Heinze que participó activamente en el estudio de química cuántica.
En el futuro, los científicos podrán desarrollar nuevas reacciones impulsadas por la luz utilizando el manganeso, un metal común y abundante. Esto no sólo sustituirá a los compuestos de rutenio e iridio, raros y más costosos, que hoy en día siguen siendo los más utilizados, sino que incluso permitirá clases de reacciones y sustratos que no están disponibles con los compuestos clásicos. "Con nuestro sistema de láser ultrarrápido recién instalado, la potencia de cálculo de los superordenadores de alto rendimiento y la creatividad y habilidades de nuestros estudiantes de doctorado, seguiremos adelante con nuestros esfuerzos para desarrollar una fotoquímica más sostenible", subrayó la profesora Katja Heinze.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.