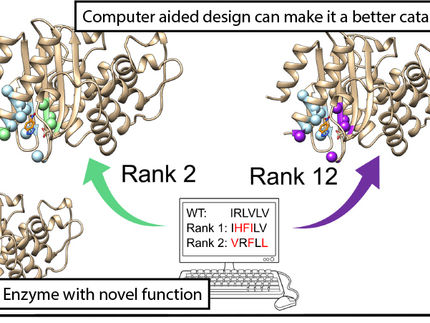
Una nueva comprensión de la catálisis enzimática
BASF y la Universidad de Graz desarrollan un modelo informático fundamentalmente nuevo para optimizar la eficiencia de los procesos de producción biocatalítica
Numerosos factores influyen en la eficacia de las enzimas utilizadas para producir sustancias químicas. Por ello, encontrar las condiciones óptimas de reacción requiere mucho tiempo y recursos. Investigadores de BASF, el Centro Austriaco de Investigación en Biotecnología Industrial (acib) y la Universidad de Graz (Austria) han desarrollado conjuntamente un modelo informático fundamentalmente nuevo que puede mejorar el rendimiento de las enzimas y permitir que los nuevos procesos de producción biocatalítica pasen más rápidamente del laboratorio a la fabricación industrial.
Las enzimas son proteínas que desempeñan muchas funciones en el cuerpo humano y en todos los demás organismos. Son catalizadores biológicos que aceleran las reacciones químicas. Las enzimas intervienen en casi todos los procesos metabólicos del organismo, como la digestión de los alimentos o la formación de células y tejidos. La industria química también utiliza enzimas como biocatalizadores en los procesos de producción. BASF las utiliza para fabricar productos como vitaminas, aromas o ingredientes para cosméticos y detergentes.
Pero las enzimas son muy sensibles y dejan de funcionar correctamente si, por ejemplo, la temperatura es demasiado alta. "Entonces dejan de estar correctamente plegadas y pierden su estructura tridimensional, lo que significa que ya no pueden producirse reacciones catalíticas en su centro activo", explica el Dr. Stefan Seemayer, responsable global de ingeniería computacional de proteínas en BASF. Sin embargo, las enzimas tampoco pueden funcionar de forma óptima cuando las temperaturas son demasiado bajas, lo que produce volúmenes inferiores del producto deseado.
La actividad de los biocatalizadores también puede verse influida por sustancias contenidas en el medio de reacción, como los disolventes. "Necesitamos disolventes para que las enzimas puedan producir rápidamente grandes cantidades del producto final deseado a partir de los materiales de partida, por ejemplo, las grasas", explica Seemayer. Sin disolventes, las enzimas no pueden acceder completamente a las sustancias y transformarlas en otros materiales. Pero si la concentración de disolvente o la temperatura son demasiado altas, las enzimas pierden su estructura y dejan de ser activas. Por otro lado, si la concentración o la temperatura son demasiado bajas, puede reducirse la producción de productos.
Encontrar una combinación óptima de temperatura y concentración de disolvente
"Para obtener las mayores cantidades posibles del producto deseado, tenemos que encontrar el punto óptimo para la enzima, en el que tanto la temperatura de reacción como la concentración de disolvente den lugar a la mayor actividad posible", subraya Seemayer.
En el pasado, determinar esta combinación óptima de temperatura y concentración de disolvente era un proceso complejo que implicaba muchos experimentos de laboratorio. Los investigadores de BASF, acib y la Universidad de Graz han desarrollado ahora un modelo de regresión como ampliación de los modelos bioquímicos convencionales. Un modelo de regresión es un método estadístico utilizado para analizar y predecir reacciones bioquímicas a partir de datos científicos recopilados. Este modelo facilita considerablemente la determinación de la combinación óptima. Sólo son necesarias algunas pruebas preliminares de laboratorio, como la determinación de la curva de desdoblamiento de la enzima. Los datos obtenidos se introducen en el modelo informático, que a continuación calcula la combinación óptima de temperatura de reacción y concentración de disolvente para obtener el mejor rendimiento posible de la enzima.
"Parece sencillo, pero mejora considerablemente la eficacia de los procesos biocatalíticos y nos permite comprender mejor la catálisis enzimática", afirma Seemayer. Debido a su gran trascendencia científica, los investigadores pudieron publicar sus hallazgos en una de las revistas científicas más renombradas, Nature Communications.
Con este nuevo método, es más fácil comparar diferentes enzimas entre sí y optimizar su rendimiento. "Esto reduce considerablemente nuestros esfuerzos para encontrar las condiciones más adecuadas para cada nuevo proceso de producción. Por tanto, podemos concluir más rápidamente nuestro trabajo de investigación y desarrollo en el laboratorio y empezar a ampliar la producción con mayor rapidez. Esto reduce significativamente los costes y el consumo de recursos, mejorando la sostenibilidad de la biocatálisis", subraya Seemayer.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.