Un catalizador innovador produce metano con electricidad
Un estudio abre nuevas vías para producir importantes compuestos químicos
Investigadores de la Universidad de Bonn y la Universidad de Montreal han desarrollado un nuevo tipo de catalizador y lo han utilizado en su estudio para producir metano a partir de dióxido de carbono y agua de forma muy eficiente utilizando electricidad. El metano puede utilizarse, por ejemplo, para calentar apartamentos o como materia prima en la industria química. También es el principal componente del gas natural. Sin embargo, si se produce utilizando electricidad verde, es en gran medida neutro para el clima. Los conocimientos adquiridos con el sistema modelo estudiado por los investigadores pueden transferirse a catalizadores técnicos a gran escala. El sistema también podría utilizarse para producir otros compuestos químicos importantes. El estudio se ha publicado recientemente en la prestigiosa revista "Nature Chemistry".
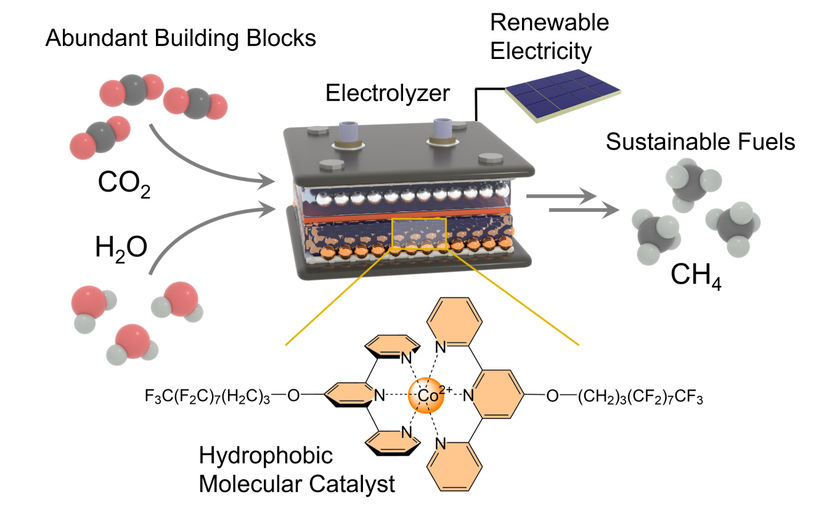
El catalizador hidrófobo (abajo) mantiene las moléculas de H2O del electrolizador (arriba) alejadas del centro activo. Extrae átomos de hidrógeno del agua y los transporta al centro activo, donde reaccionan con el carbono para formar metano.
Nikolay Kornienko
Muchas reacciones químicas requieren energía para ponerse en marcha y esta energía puede añadirse, por ejemplo, calentando los socios de la reacción o sometiéndolos a alta presión. "Nosotros, en cambio, utilizamos la electricidad como fuerza motriz", explica el Prof. Dr. Nikolay Kornienko. "Al utilizar electricidad respetuosa con el clima, podemos producir, por ejemplo, metano que no contribuye al calentamiento global".
El investigador se trasladó recientemente de la Universidad de Montreal al Instituto de Química Inorgánica de la Universidad de Bonn. Comenzó su último estudio cuando aún estaba en Canadá y lo concluyó en su nuevo hogar. "La producción de metano -que tiene la fórmula química CH4- supone un reto porque es necesario llevar a cabo una reacción entre un gas y un líquido", explica Kornienko.
En este caso, se trata de dióxido de carbono (CO2) y agua (H2O). Los investigadores utilizaron un electrodo de difusión de gas para unir a estos dos compañeros. En la reacción, es necesario separar los dos átomos de oxígeno (símbolo químico: O) del átomo de carbono (C) y sustituirlos por cuatro átomos de hidrógeno (H). El hidrógeno se obtiene del agua.
Prevención de reacciones secundarias
El problema de este proceso es que el agua prefiere sufrir otra reacción y se divide en hidrógeno y oxígeno en cuanto se expone a una corriente eléctrica. "Se trata de una reacción competidora que tenemos que evitar", subraya Morgan McKee, ayudante de Kornienko, que llevó a cabo gran parte de los experimentos. "De lo contrario, nos impediría producir metano. Por lo tanto, tenemos que evitar que el agua entre en contacto con el electrodo. Al mismo tiempo, seguimos necesitando el agua como compañera de reacción".
Aquí es donde entra en juego el nuevo catalizador, que se deposita en el electrodo. Garantiza sobre todo que el dióxido de carbono reaccione más fácil y rápidamente para producir metano. Lo consigue gracias a su "centro activo", que retiene el dióxido de carbono y, en pocas palabras, debilita los enlaces entre el átomo de carbono y los dos átomos de oxígeno.
En el siguiente paso, estos átomos de oxígeno se sustituyen gradualmente por cuatro átomos de hidrógeno. El catalizador necesita agua en esta fase del proceso. Sin embargo, también tiene que mantenerla a distancia para evitar reacciones secundarias no deseadas. "Para lograrlo, unimos largas cadenas moleculares laterales al centro activo", explica el profesor Kornienko, que también es miembro del Área de Investigación Transdisciplinar "Materia" de la Universidad de Bonn. "Su estructura química repele el agua o, en otras palabras, son hidrófobas".
Cadenas moleculares que repelen el agua
Este término especializado procede del griego y significa literalmente "tener miedo al agua". Las cadenas laterales no sólo mantienen a las moléculas de H2O alejadas del centro activo y del electrodo, sino que también actúan como una especie de cinta transportadora. En sentido figurado, arrebatan átomos de hidrógeno a las moléculas de agua y los transportan al centro activo, donde reaccionan con el átomo de carbono. De este modo, el CO2 se convierte en CH4 en varias etapas.
Este proceso tiene una eficacia superior al 80% y la reacción apenas produce productos secundarios no deseados. Sin embargo, el catalizador no es realmente adecuado para la producción de metano a gran escala. "No obstante, los principios de reacción que hemos logrado con este catalizador podrían realizarse en otros materiales catalizadores para su uso en aplicaciones técnicas a gran escala", afirma Kornienko.
El investigador cree que la producción de metano no es el único campo de aplicación de este método. En su opinión, podría resultar más lucrativo en la producción de otros compuestos químicos como el etileno, que se utiliza como material de partida para muchos plásticos. Así pues, a medio plazo, el nuevo método catalizador podría utilizarse en la medida de lo posible para que la producción de plásticos sea más respetuosa con el medio ambiente.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Morgan McKee, Maximilian Kutter, Yue Wu, Hannah Williams, Marc-Antoine Vaudreuil, Mariolino Carta, Ashok Kumar Yadav, Harishchandra Singh, Jean-François Masson, Dieter Lentz, Moritz F. Kühnel, Nikolay Kornienko; "Hydrophobic assembly of molecular catalysts at the gas–liquid–solid interface drives highly selective CO2 electromethanation"; Nature Chemistry, 2024-10-4





































