Desarrollan un método para fabricar pilas de combustible con menos platino
Un equipo internacional de investigadores, entre los que se encuentran científicos del Consejo Superior de Investigaciones Científicas (CSIC), ha logrado multiplicar por 10 la velocidad a la que transcurre la reducción de oxígeno sobre platino, una reacción electroquímica de la que depende la potencia eléctrica proporcionada por las pilas de combustible. El nuevo método podría permitir fabricar cátodos para estas pilas con una cantidad mucho menor de platino, lo que las haría económicamente más competitivas. Los resultados del trabajo aparecen publicados en Nature Chemistry.
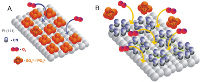
Representación esquemática del proceso de ruptura del enlace O-O en la molécula de oxÃgeno (O2) en presencia de ácido sulfúrico o ácido fosfórico, sobre platino limpio (A) y platino modificado con cianuro (B).
Las pilas de combustible convierten directamente la energía química contenida en hidrógeno en energía eléctrica, generando agua como único producto. Que sean más o menos potentes depende del producto del voltaje de la pila por la corriente eléctrica que fluye cuando se cierra el circuito. Esta corriente es equivalente a la velocidad de dos reacciones electroquímicas: la oxidación del hidrógeno y la reducción del oxígeno.
“Una de las principales limitaciones para el desarrollo de este tipo de tecnología es la baja velocidad a la que ocurre la reducción de oxígeno, lo que implica menor potencia para un mismo voltaje. Además, que haya que utilizar grandes cantidades de platino para conseguir la potencia deseada encarece demasiado las pilas de combustible”, explica uno de los autores del trabajo, el investigador del CSIC Ángel Cuesta.
El grupo de Cuesta en el Instituto de Química y Física Rocasolano, en colaboración con científicos del Argonne National Laboratory, en Illinois (Estados Unidos), ha centrado su atención en manipular los átomos presentes en la superficie del platino, un metal normalmente empleado como catalizador de la pila por ser el más activo en acelerar la reacción química necesaria para generar electricidad.
“Hemos intentado mantener las propiedades químicas de los átomos superficiales del platino y hemos modificado el tamaño y la estructura geométrica de los grupos de átomos de platino expuestos al medio interno de la pila o electrolito”, destaca Cuesta.
Durante los experimentos, los investigadores consiguieron retener moléculas de cianuro sobre la superficie de un electrodo de platino con el objetivo de que quedasen dos o tres átomos de platino en línea, necesarios para que se rompiese el enlace O-O en la molécula de oxígeno (O2). “De esta forma, la velocidad a la que transcurre la reducción de oxígeno se multiplica por 10 empleando ácido fosfórico como conductor eléctrico y por 25 en el caso de ácido sulfúrico”, agrega el investigador del CSIC.
Dusan Strmcnik, Maria Escudero-Escribano, Kensaku Kodama, Vojislav. R. Stamenkovic, Ángel Cuesta y Nenad M. Markovic; "Enhanced electrocatalysis of the oxygen reduction reaction based on patterning of platinum surfaces with cyanide."; Nature Chemistry 2010.
Noticias más leídas
Más noticias del departamento ciencias

Reciba la química en su bandeja de entrada
Al enviar el formulario, se muestra usted de acuerdo con que LUMITOS AG le envíe por correo electrónico el boletín o boletines seleccionados anteriormente. Sus datos no se facilitarán a terceros. El almacenamiento y el procesamiento de sus datos se realiza sobre la base de nuestra política de protección de datos. LUMITOS puede ponerse en contacto con usted por correo electrónico a efectos publicitarios o de investigación de mercado y opinión. Puede revocar en todo momento su consentimiento sin efecto retroactivo y sin necesidad de indicar los motivos informando por correo postal a LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlín (Alemania) o por correo electrónico a revoke@lumitos.com. Además, en cada correo electrónico se incluye un enlace para anular la suscripción al boletín informativo correspondiente.