Nuevos avances en la producción de energía limpia basada en enzimas
El oxígeno inhibe las hidrogenasas, un grupo de enzimas que son capaces de producir y disociar el hidrógeno. Esta degradación es fatal para las posibles aplicaciones biotecnológicas de estas enzimas en la producción de la energía limpia. Es, por tanto, esencial comprender los mecanismos de dicho proceso. Un equipo internacional liderado por los investigadores de los centros UCL (Reino Unido) y CNRS (Francia), junto con un investigador Ikerbasque de nanoGUNE, ha combinado teoría y experimentos para caracterizar cada una de las etapas de la reacción química que da lugar a la reducción de oxígeno mediada por la enzima. Los resultados de este trabajo han sido publicados en Nature Chemistry.
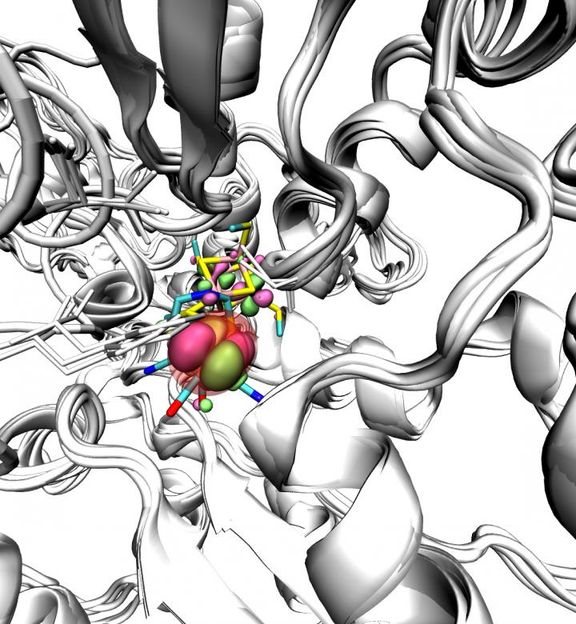
Visualization of the active site (coloured sticks) that is degraded by oxygen molecules within the core of the Fe-Fe hydrogenase with SOMO orbitals shown in green/pink.
CIC nanoGUNE
Los combustibles fósiles suponen más del 80% de la energía consumida en el mundo. Desde las crisis energéticas de los años 70 y luego en la década de los 90, cuando surgió la preocupación por el efecto invernadero, la búsqueda de fuentes alternativas de energía ha sido constante. El hidrógeno ha sido un candidato particularmente popular ya que su combustión sólo produce agua. La biotecnología tiene una posición privilegiada para explotar esta fuente de energía alternativa. Una de las posibilidades es el uso de las enzimas llamadas hidrogenasas que se encuentran en diversos microorganismos que viven en ecosistemas anaeróbicos, por ejemplo, algunas bacterias que viven en la tierra y en el tracto intestinal de los animales, o algas unicelulares.
Las hidrogenasas catalizan la conversión de los protones en las moléculas de hidrógeno (H2), cuya combustión libera energía que puede ser utilizada, por ejemplo, en pilas de combustible y, por tanto, ser parte de dispositivos biotecnológicos. El sitio activo que cataliza esta reacción contiene iones metálicos (hierro o hierro y níquel). Las hidrogenasas que contienen únicamente hierro son las más activas para la producción de moléculas de hidrógeno. Su sitio activo - llamado cluster-H - es sumamente complejo y está escondido dentro del núcleo de una proteína de gran tamaño. Uno de los principales problemas para el uso de las hidrogenasas en las aplicaciones biotecnológicas es que cuando se llevan a las condiciones aeróbicas de un biorreactor (con una presión normal de oxígeno), el oxígeno molecular degrada su sitio activo. La comprensión del mecanismo del proceso de degradación del cluster-H es, por tanto, esencial para diseñar una pila de combustible basada en hidrógeno. Sin embargo, los estudios realizados hasta ahora no habían sido concluyentes.
Para resolver este dilema, un equipo internacional de investigadores ha combinado experimentos, simulaciones moleculares y cálculos teóricos. A través del uso de métodos electroquímicos, los investigadores han medido con precisión las diferentes etapas de la reacción implicadas en la degradación de las enzimas. Han estudiado la dependencia de estas tasas en parámetros experimentales como el potencial del electrodo, el pH, el intercambio H2O/D2O y la mutación de aminoácidos específicos en la proteína. Los resultados confirman las predicciones de los cálculos teóricos. Por un lado, las simulaciones de dinámica molecular, realizadas por el investigador Ikerbasque de nanoGUNE David de Sancho, muestran los túneles que el oxígeno sigue para llegar al sitio activo de la proteína, un paso necesario para la degradación y la identificación de posibles puntos conflictivos para el bloqueo de estos túneles de acceso. Por otro lado, la teoría del funcional de la densidad se ha utilizado para esclarecer los productos de reacción y evaluar las constantes de velocidad para cada una de las etapas de la reacción.
El estudio, en Nature Chemistry ha permitido caracterizar de forma inequívoca las complejas reacciones que se producen en estas grandes macromoléculas biológicas mediante el uso de una innovadora combinación de métodos computacionales y experimentales. "A pesar de que en las aplicaciones industriales existen aún grandes desafíos, este estudio abre nuevas vías para la explotación de las enzimas de los sistemas vivos de manera eficiente en la producción de la energía limpia", dice De Sancho.