Hallada una nueva molécula capaz de modificar el número de contactos sinápticos entre neuronas
El trabajo liderado por el CSIC abre la puerta al diseño de nuevos fármacos para tratar el autismo o el Alzheimer
Un equipo multidisciplinar de investigadores del Instituto de Química-Física Rocasolano, el Centro de Investigaciones Biológicas y el Instituto Cajal, tres centros del Consejo Superior de Investigaciones Científicas (CSIC), ha hallado una nueva molécula capaz de modificar el número de contactos sinápticos entre las neuronas. El trabajo, publicado en Proceedings of the National Academy of Sciences (PNAS), abre la puerta al desarrollo de nuevos fármacos para tratar enfermedades neuronales con alteración de la sinapsis, como en el caso del autismo y el Alzheimer.
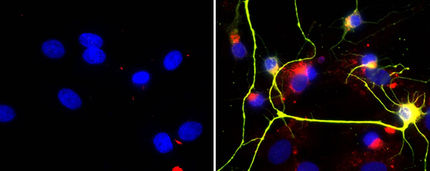
La nueva molécula, pequeña, es capaz de inhibir la interacción entre dos proteínas, NCS-1 y Ric8a, que tienen una superficie de contacto grande y compleja. Hasta ahora se ha mostrado eficaz en ensayos con células humanas y en un modelo de mosca Drosophila del síndrome del cromosoma X frágil, una forma severa de autismo.
“Dado que la mayoría de trastornos neurales empiezan siendo patologías de la sinapsis, el modo en que se comunican las neuronas, disponer de fármacos que modifiquen esta estructura básica neural supone dotar a la medicina de una herramienta potencialmente muy poderosa”, explica la investigadora del CSIC María José Sánchez Barrena, que trabaja en el Instituto de Química-Física Rocasolano.
Lo pequeño modula lo grande
Según el trabajo, la administración oral de esta molécula, una fenotiazina, consigue reducir “el número aberrantemente alto de sinapsis” y restaurar los niveles de aprendizaje y memoria en el síndrome del cromosoma X frágil. Además, los estudios llevados a cabo mediante cristalografía de rayos X han permitido demostrar el mecanismo de acción de la molécula a nivel atómico.
La ruta sobre la que actúa la fenotiazina coregula el número de sinapsis y, al mismo tiempo y en dirección contraria, la probabilidad de liberación del neurotransmisor (la molécula que transmite información de una neurona a otra consecutiva).
“Esta coregulación es muy importante, porque la práctica totalidad de fármacos disponibles hasta ahora para modular la actividad sináptica están dirigidos contra la probabilidad de liberación del neurotransmisor o contra el número de sinapsis, pero no contra ambos. Así, afectar uno solo de estos dos factores acarrea efectos secundarios no deseados en el otro factor”, señala Alberto Ferrús, investigador del CSIC en el Instituto Cajal.
Los datos estructurales a resolución atómica permitieron a los investigadores hacer un rastreo informático entre las moléculas sintetizadas disponibles en una quimioteca, de forma que pudieron seleccionar un reducido número de candidatos con las propiedades adecuadas para encajar en una cavidad que NCS-1 presenta en su superficie para interaccionar con Ric8a. La inhibición de este complejo proteico mediada por los compuestos desencadenaría la cascada de eventos que finalmente determinan el número y actividad de sinapsis en una neurona.
“Cabe esperar, por tanto, que la nueva fenotiazina permita diseñar una nueva generación de fármacos realmente eficaces en estas patologías severas”, agrega la investigadora del CSIC Ana Martínez, del Centro de Investigaciones Biológicas.
Publicación original
Alicia Mansilla, Antonio Chaves-Sanjuan, Nuria E. Campillo, Ourania Semelidou, Loreto Martínez-González, Lourdes Infantes, Juana María González-Rubio, Carmen Gil, Santiago Conde, Efthimio M. C. Skoulakis, et al. "The interference of the complex between NCS-1 and Ric8a with phenothiazines regulates synaptic function and is an approach for fragile X syndrome."; PNAS.
Noticias más leídas
Publicación original
Alicia Mansilla, Antonio Chaves-Sanjuan, Nuria E. Campillo, Ourania Semelidou, Loreto Martínez-González, Lourdes Infantes, Juana María González-Rubio, Carmen Gil, Santiago Conde, Efthimio M. C. Skoulakis, et al. "The interference of the complex between NCS-1 and Ric8a with phenothiazines regulates synaptic function and is an approach for fragile X syndrome."; PNAS.
Temas
Organizaciones
Más noticias del departamento ciencias

Reciba la química en su bandeja de entrada
Al enviar el formulario, se muestra usted de acuerdo con que LUMITOS AG le envíe por correo electrónico el boletín o boletines seleccionados anteriormente. Sus datos no se facilitarán a terceros. El almacenamiento y el procesamiento de sus datos se realiza sobre la base de nuestra política de protección de datos. LUMITOS puede ponerse en contacto con usted por correo electrónico a efectos publicitarios o de investigación de mercado y opinión. Puede revocar en todo momento su consentimiento sin efecto retroactivo y sin necesidad de indicar los motivos informando por correo postal a LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlín (Alemania) o por correo electrónico a revoke@lumitos.com. Además, en cada correo electrónico se incluye un enlace para anular la suscripción al boletín informativo correspondiente.