Identificado un mecanismo clave en el funcionamiento del supresor tumoral Capicua
Un estudio con investigadores del CSIC ha caracterizado la unión de Capicua al ADN y el modo en que este proceso se ve alterado por mutaciones en diferentes tumores
Un equipo de investigadores del Consejo Superior de Investigaciones Científicas (CSIC) en colaboración con el grupo dirigido por Mariano Barbacid en el Centro Nacional de Investigaciones Oncológicas ha identificado un mecanismo que ayuda a comprender mejor la aparición de algunos tipos de cáncer. Se trata del proceso por el que un nuevo dominio del supresor tumoral Capicua contribuye a su función durante el control del crecimiento celular. Comprender cómo trabajan estas proteínas reguladoras es fundamental porque las mutaciones que alteran o inactivan su función son la causa más general de la aparición del cáncer.
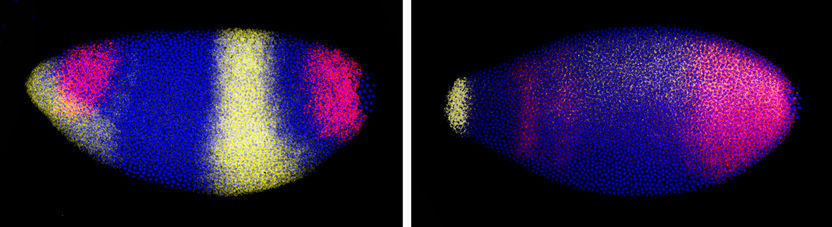
Expresión de genes regulados por Capicua en un embrión normal de ‘Drosophila’ (izquierda) y en un embrión afectado por una mutación en el dominio C1 de la proteína (derecha).
“Aunque la existencia de este dominio se conoce desde el descubrimiento de Capicua hace más de 15 años, hasta ahora ha sido un misterio de qué manera contribuye a la actividad de la proteína”, indica Marta Forés, investigadora del CSIC y firmante del estudio.
“El supresor tumoral Capicua funciona normalmente reprimiendo la expresión de genes específicos en el núcleo de la célula. Cuando su función es inactivada por mutaciones, se producen cambios en la expresión de genes diana que promueven la formación de gliomas cerebrales y de metástasis”, explica Gerardo Jiménez, investigador ICREA en el Instituto de Biología Molecular de Barcelona, y responsable principal del estudio.
“También se han descrito aberraciones cromosómicas que dan lugar a fusiones de la proteína Capicua completa con un fragmento del factor DUX4, generando un producto quimérico Capicua-DUX4 que activa la expresión génica en vez de reprimirla, lo que provoca la formación de sarcomas en tejidos blandos”, señala el investigador.
“Una buena parte de las mutaciones que inactivan a Capicua afectan a su dominio HMG-box, necesario para la unión al ADN de genes diana. Sin embargo, un número considerable de mutaciones alteran (o eliminan) un dominio distinto denominado C1 presente en el extremo final de la proteína”, señala Forés.
“Para identificar la función del dominio C1 hemos utilizado la mosca Drosophila y células humanas, y hemos descubierto que C1 actúa junto al dominio HMG-box en la unión de Capicua al ADN, siendo ambos dominios necesarios para este proceso. Por tanto, la gran mayoría de mutaciones en Capicua identificadas hasta el momento, aun afectando a distintas regiones de la proteína, causan en realidad un defecto similar en el reconocimiento del ADN”, explica el investigador.
“Además, nuestros resultados también explican la estructura típica de las fusiones Capicua-DUX4, ya que estas fusiones deben contener la secuencia completa de Capicua con el dominio C1 final intacto para reconocer a sus genes diana y activarlos durante el proceso oncogénico. En conclusión, nuestro trabajo supone un avance en la comprensión del mecanismo de acción de Capicua, lo que en el futuro facilitará la interpretación de mutaciones en este factor, así como el diseño de posibles tratamientos especializados”, señala Jiménez.