La estructura oculta de la tabla periódica
La conocida representación de los elementos químicos es sólo un ejemplo de cómo se pueden organizar y clasificar los objetos.
La tabla periódica de los elementos que la mayoría de los libros de química representan es un caso especial. Para esta visión tabular de los elementos químicos, que se remonta a Dmitri Mendeleev y Lothar Meyer, y los enfoques de otros químicos para organizar los elementos, son diferentes formas de representación de una estructura oculta de los elementos químicos. Esta es la conclusión a la que han llegado los investigadores del Instituto Max Planck de Matemáticas en Ciencias Naturales de Leipzig y de la Universidad de Leipzig en un artículo reciente. El enfoque matemático de los científicos de Leipzig es muy general y puede proporcionar muchos sistemas periódicos diferentes dependiendo del principio de orden y clasificación, no sólo para la química, sino también para muchos otros campos del conocimiento.
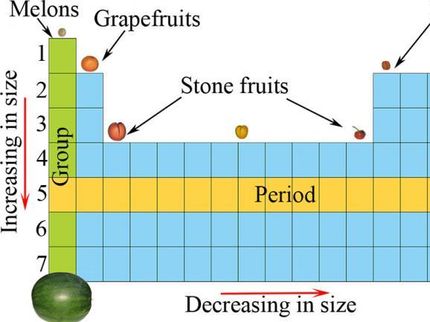
La tabla de elementos químicos, que se remonta a Dmitri Mendeleev y Lothar Meyer, es sólo un ejemplo de cómo los objetos -en este caso los elementos químicos- pueden organizarse en un sistema de este tipo. Los investigadores de Leipzig ilustran la estructura general de una tabla periódica con este ejemplo: Los puntos negros representan los objetos ordenados por las flechas verdes. Utilizando un criterio adecuado, los objetos pueden clasificarse en grupos (líneas de puntos) en los que las flechas rojas crean una subordinación.
© Guillermo Restrepo, MPI für Mathematik in den Naturwissenschaften
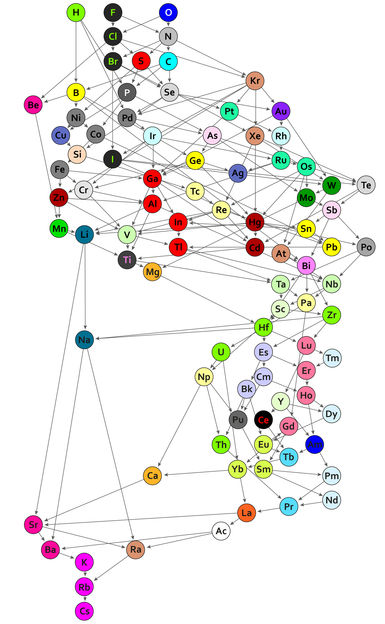
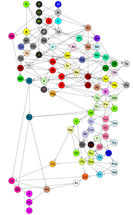
Una tabla periódica de compuestos químicos: Cada uno de los 94 círculos con símbolos de elementos químicos representa la unión que el elemento respectivo forma con un residuo orgánico. Los enlaces están ordenados de acuerdo a la fuerza con la que están polarizados. Donde hay una conexión de flecha directa, el orden es claro: los enlaces de hidrógeno, por ejemplo, están más polarizados que los de boro, fósforo y paladio. Lo mismo se aplica al rubidio en comparación con el cesio, que tiene enlaces de polarización particularmente baja y, por lo tanto, se encuentra en la parte inferior de la nueva tabla periódica. Si no hay una flecha directa entre dos elementos, pueden ser comparables - si hay una cadena de flechas entre ellos. Por ejemplo, los enlaces de oxígeno están más polarizados que los enlaces de bromo. Los bonos representados por el mismo color tienen el mismo comportamiento vinculante y pertenecen a una de las 44 clases.
© Guillermo Restrepo, MPI für Mathematik in den Naturwissenschaften
Es un icono de las ciencias naturales y cuelga en la mayoría de las aulas de química: la tabla periódica de elementos, que este año celebra su 150 aniversario. El resumen tabular está estrechamente relacionado con los nombres de Dmitri Mendeleev y Lothar Meyer, dos investigadores que, en la década de 1860, crearon una disposición de elementos basada en sus masas atómicas y similitudes. Hoy en día están ordenados por el número atómico, que indica el número de protones en el núcleo atómico - desde el hidrógeno ligero (un protón) hasta el exótico Oganesson (118 protones). Los elementos también se clasifican en grupos: Los átomos en la misma columna generalmente tienen el mismo número de electrones en la capa externa de su capa de electrones.
Sistemas periódicos en diferentes variantes
A primera vista, la tabla periódica parece haber aportado un orden inequívoco y definitivo a los 118 elementos actualmente conocidos. Pero las apariencias engañan, porque muchas cosas siguen siendo controvertidas hoy en día: los científicos no están de acuerdo en qué elementos pertenecen exactamente al tercer grupo debajo del escandio y el itrio. Por ejemplo, se discute la posición correcta del lantano y el actinio. Si se mira más de cerca, se descubren variantes ligeramente diferentes de la tabla periódica en las aulas, aulas y libros de texto.
Guillermo Restrepo y Wilmer Leal, que trabajaron en el Instituto Max Planck de Matemáticas en Ciencias Naturales y en la Universidad de Leipzig, no se sorprenden. Para ellos, no existe una disposición inequívocamente correcta de los elementos, ya que dependiendo del criterio aplicado para la clasificación, resulta una tabla periódica diferente. Los átomos pueden subdividirse según la configuración electrónica, es decir, el número y la disposición de sus electrones, su comportamiento químico, su solubilidad o su presencia en depósitos geológicos. Hoy en día es ampliamente aceptado ordenar los elementos químicos de acuerdo a su número atómico y dividirlos en grupos de acuerdo a su configuración electrónica. Pero incluso a partir de esta tabla periódica existen numerosas formas diferentes de representación, por ejemplo como una espiral con diferentes protuberancias más o menos grandes, en forma de pirámide o como una flor tridimensional.
Una estructura común
Guillermo Restrepo y Wilmer Leal han investigado sistemáticamente la ambigüedad de la tabla periódica. Esto ha llevado a hallazgos que también son significativos más allá de la química. Por consiguiente, todas las formas de representación de los elementos químicos se basan en una estructura común, que los matemáticos llaman hipergrafía ordenada. La venerable tabla periódica de Mendeleev y Meyer sólo ofrece una representación de la estructura general que Guillermo Restrepo y Wilmer Leal postulan ahora. De ello pueden derivarse nuevos acuerdos en cualquier momento. Guillermo Restrepo compara así el orden de los elementos químicos con una escultura sobre la que la luz cae desde diferentes direcciones. "Las diferentes sombras que proyecta la figura son las tablas de la época. Por eso hay tantas maneras de crear estas tablas. En cierto modo, las tablas de períodos son proyecciones. Proyecciones de la estructura interna de la tabla periódica".
Los científicos de Leipzig intentan ahora determinar la estructura matemática oculta en la que se basan los sistemas periódicos conocidos de química. Por el momento, han definido tres condiciones que deben cumplirse para establecer una tabla periódica. Claro, primero necesitas objetos que se van a pedir: Para Mendeleev, Meier y los creadores de los otros sistemas periódicos conocidos de la química, estos son los elementos químicos. Estos objetos deben estar dispuestos según una propiedad, como la masa atómica o el número atómico, es decir, el número de protones. Finalmente, se requiere un criterio para agrupar los objetos en clases. Mendeleev y Meier usaron la similitud química para esto.
Sistema periódico de enlaces químicos
"Si se cumplen estas tres condiciones, también se pueden crear sistemas periódicos para otros objetos químicos e incluso para objetos fuera de la química", dice Guillermo Restrepo. Él y Wilmer Leal lo demuestran observando los vínculos químicos entre los átomos de 94 elementos y los diferentes socios como objetos ejemplares. Los ordenan según la electronegatividad del elemento en cuestión y su radio atómico en este enlace. El flúor, el cloro o el oxígeno, por ejemplo, son muy electronegativos y asumen radios atómicos relativamente pequeños en los compuestos. A continuación, clasifican las fijaciones en función de si se parecen entre sí.
"Hemos investigado casi 5.000 sustancias que consisten en dos elementos en proporciones diferentes", explica Guillermo Restrepo. "Luego buscamos similitudes en estas fechas. Por ejemplo, el sodio y el litio son similares porque se combinan con los mismos elementos en las mismas proporciones: oxígeno o cloro, bromo y yodo, por ejemplo. Así que encontramos patrones para clasificar los elementos".
Una red en lugar de una matriz
En las 44 clases de compuestos químicos hay algunas similitudes con los principales grupos de la tabla periódica de Mendeleev y Meier. Por ejemplo, los metales alcalinos sodio y litio se encuentran en un grupo porque forman las mismas sales simples con halógenos como el cloro o el flúor. Al igual que los elementos mismos, los enlaces de los cuatro halógenos flúor, cloro bromo y yodo también se encuentran en un grupo. Sin embargo, también hay clasificaciones que difieren significativamente de las de la tabla periódica convencional. El carbono y el silicio, por ejemplo, ya no se encuentran en la misma clase porque forman compuestos muy diferentes.
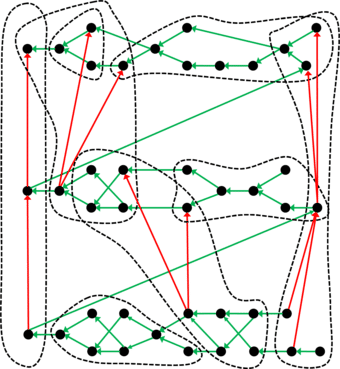
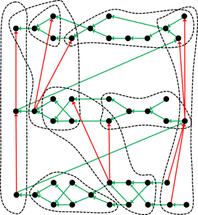
La representación de la tabla periódica de enlaces químicos tampoco tiene nada que ver con la conocida disposición matricial de las tablas periódicas clásicas de los elementos. En cambio, los 94 enlaces covalentes se representan en una red de círculos de diferentes colores, donde cada círculo representa un enlace químico y el color simboliza la pertenencia a uno de los 44 grupos. Puesto que ahora se utilizan dos criterios para la clasificación, ya no hay un orden claro de los átomos como en el caso de Mendelejew y Meyer - los matemáticos hablan de un orden parcial. Por lo tanto, los círculos están conectados a otros círculos por medio de una o más flechas, creando un hipergrafo ordenado.
Sistemas periódicos en otras ciencias
Los elementos químicos y sus compuestos también pueden representarse en sistemas periódicos completamente diferentes, dependiendo del orden subyacente y del principio de clasificación. Y aún más: los objetos de muchas otras ciencias y sus aplicaciones también se pueden organizar en sistemas periódicos. Por ejemplo, los hipergrafos ordenados se utilizan en sistemas de información y en la minería web. Los posibles sistemas periódicos también surgen cuando se consideran los países, que pueden clasificarse según los indicadores sociales o económicos y la proximidad geográfica o la similitud cultural. Otros ejemplos pueden encontrarse en ingeniería, ciencias ambientales, sociología y muchas otras disciplinas. Por lo tanto, los científicos estudian los sistemas periódicos no sólo por su interés en la química, sino sobre todo por sus aplicaciones en muchas otras disciplinas.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Alemán se puede encontrar aquí.