La investigación proporciona un nuevo principio de diseño para los catalizadores de separación de agua
Los científicos saben desde hace tiempo que el platino es, con mucho, el mejor catalizador para separar las moléculas de agua y producir gas de hidrógeno. Un nuevo estudio realizado por investigadores de la Universidad de Brown muestra por qué el platino funciona tan bien, y no es la razón por la que se ha asumido.
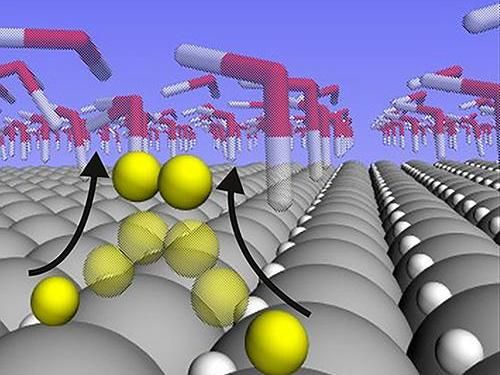
Un nuevo estudio muestra que los átomos de hidrógeno están sueltos y son altamente móviles en la superficie de un catalizador de platino durante la reacción de división del agua. Los hallazgos explican por qué el platino es tan bueno para catalizar esta reacción particular, y podría ayudar en el diseño de catalizadores hechos de materiales que son más baratos y más abundantes que el platino.
Peterson Lab / Brown University
La investigación, publicada en ACS Catalysis, ayuda a resolver una cuestión de investigación casi centenaria, señalan los autores. Y podría ayudar en el diseño de nuevos catalizadores para producir hidrógeno que son más baratos y más abundantes que el platino. Esto podría ayudar en última instancia a reducir las emisiones de los combustibles fósiles.
"Si podemos descubrir cómo hacer hidrógeno de manera barata y eficiente, esto abre la puerta a muchas soluciones pragmáticas para combustibles y químicos libres de fósiles," dijo Andrew Peterson, un profesor asociado en la Escuela de Ingeniería de Brown y el autor principal del estudio. "El hidrógeno puede ser usado en celdas de combustible, combinado con el exceso de CO2 para hacer combustible o combinado con nitrógeno para hacer fertilizante de amoníaco. Hay mucho que podemos hacer con el hidrógeno, pero para hacer de la división del agua una fuente de hidrógeno escalable, necesitamos un catalizador más barato".
El diseño de nuevos catalizadores comienza con la comprensión de lo que hace que el platino sea tan especial para esta reacción, dice Peterson, y eso es lo que esta nueva investigación pretendía averiguar.
El éxito del platino se atribuye desde hace mucho tiempo a su energía de unión "Ricitos de Oro". Los catalizadores ideales se aferran a las moléculas que reaccionan, ni demasiado flojas ni demasiado apretadas, sino en algún punto intermedio. Si las moléculas están demasiado sueltas, es difícil que se produzca una reacción. Si se unen demasiado fuerte, las moléculas se adhieren a la superficie del catalizador, lo que hace que la reacción sea difícil de completar. La energía de unión del hidrógeno con el platino resulta equilibrar perfectamente las dos partes de la reacción de separación del agua - y así la mayoría de los científicos han creído que es ese atributo el que hace al platino tan bueno.
Pero había razones para cuestionar si esa imagen era correcta, dice Peterson. Por ejemplo, un material llamado disulfuro de molibdeno (MoS2) tiene una energía de unión similar a la del platino, pero es un catalizador mucho peor para la reacción de separación de agua. Eso sugiere que la energía de unión no puede ser la historia completa, dice Peterson.
Para averiguar lo que estaba sucediendo, él y sus colegas estudiaron la reacción de ruptura de agua en los catalizadores de platino utilizando un método especial que desarrollaron para simular el comportamiento de los átomos y electrones individuales en las reacciones electroquímicas.
El análisis mostró que los átomos de hidrógeno que están ligados a la superficie del platino en la energía de unión de "Ricitos de Oro" no participan realmente en la reacción en absoluto cuando la tasa de reacción es alta. En cambio, se anidan en la capa cristalina superficial del platino, donde permanecen como espectadores inertes. Los átomos de hidrógeno que participan en la reacción están mucho más débilmente ligados que la supuesta energía de "Ricitos de Oro". Y en lugar de anidar en la red, se sientan sobre los átomos de platino, donde son libres de reunirse entre sí para formar gas H2.
Es esa libertad de movimiento de los átomos de hidrógeno en la superficie lo que hace al platino tan reactivo, concluyen los investigadores.
"Lo que esto nos dice es que buscar esta energía vinculante de 'Ricitos de Oro' no es el principio de diseño correcto para la región de alta actividad", dijo Peterson. "Sugerimos que el diseño de catalizadores que pongan al hidrógeno en este estado altamente móvil y reactivo es el camino a seguir."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.




















































