Los científicos se basan en pares de átomos que impulsan la actividad de un catalizador...
Descubrieron que el entorno desordenado de una reacción química puede cambiar la forma de una nanopartícula catalítica de una manera que la hace más activa
La sustitución de los metales caros que descomponen los gases de escape en los convertidores catalíticos por materiales más baratos y eficaces es una prioridad fundamental para los científicos, tanto por razones económicas como ambientales. Los catalizadores son necesarios para realizar reacciones químicas que de otro modo no se producirían, como la conversión de los gases contaminantes de los gases de escape de los automóviles en compuestos limpios que puedan liberarse en el medio ambiente. Para mejorarlos, los investigadores necesitan una comprensión más profunda de cómo funcionan exactamente los catalizadores.

Un estudio en SLAC y Stanford identificó qué pares de átomos en una nanopartícula catalizadora son más activos en una reacción que descompone un gas de escape dañino en los convertidores catalíticos. Las partículas más activas contenían la mayor proporción de una configuración atómica particular, una en la que dos átomos, cada uno rodeado por siete átomos vecinos, forman pares para llevar a cabo los pasos de la reacción.
Greg Stewart/SLAC National Accelerator Laboratory
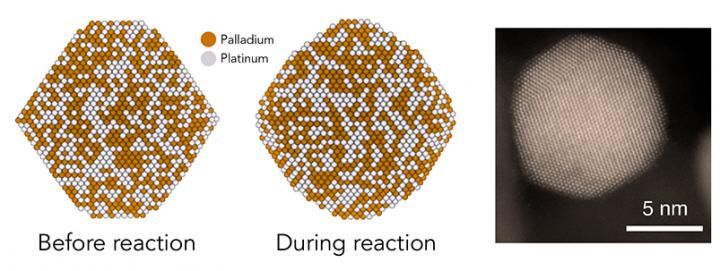
En un estudio en SLAC y Stanford, los teóricos predijeron que las nanopartículas catalizadoras hechas de paladio y platino (izquierda) se redondearían durante ciertas reacciones químicas (centro), creando rasgos escalonados con pares de átomos que son sitios catalíticos especialmente activos. Experimentos e imágenes de microscopios electrónicos como el de la derecha confirmaron que este es el caso, ofreciendo una nueva comprensión de cómo funcionan los catalizadores.
Greg Stewart/SLAC National Accelerator Laboratory

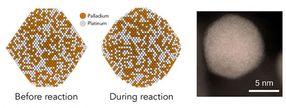
Ahora un equipo de la Universidad de Stanford y el Laboratorio Nacional de Aceleradores SLAC del Departamento de Energía ha identificado exactamente qué pares de átomos en una nanopartícula de paladio y platino - una combinación comúnmente utilizada en los convertidores - son los más activos en la descomposición de esos gases.
También respondieron a una pregunta que ha desconcertado a los investigadores de catalizadores: ¿Por qué las partículas de catalizador más grandes a veces funcionan mejor que las más pequeñas, cuando se esperaría lo contrario? La respuesta tiene que ver con la forma en que las partículas cambian de forma durante el curso de las reacciones, creando más de esos sitios altamente activos.
Los resultados son un paso importante hacia la ingeniería de catalizadores para un mejor rendimiento tanto en los procesos industriales como en el control de las emisiones, dijo Matteo Cargnello, un profesor asistente de ingeniería química en Stanford que dirigió el equipo de investigación.
"El resultado más emocionante de este trabajo fue identificar dónde se produce la reacción catalítica - en qué sitios atómicos se puede realizar esta química que toma un gas contaminante y lo convierte en agua y dióxido de carbono inofensivos, lo cual es increíblemente importante e increíblemente difícil de hacer", dijo Cargnello. "Ahora que sabemos dónde están los sitios activos, podemos diseñar catalizadores que funcionen mejor y usen ingredientes menos costosos".
En el convertidor catalítico de un coche, las nanopartículas de metales preciosos como el paladio y el platino están adheridas a una superficie cerámica. A medida que los gases de emisión pasan, los átomos de la superficie de las nanopartículas se aferran a las moléculas de gas que pasan y las animan a reaccionar con el oxígeno para formar agua, dióxido de carbono y otros productos químicos menos dañinos. Una sola partícula cataliza miles de millones de reacciones antes de agotarse.
Los convertidores catalíticos de hoy en día están diseñados para funcionar mejor a altas temperaturas, dijo Cargnello, por lo que la mayoría de las emisiones de gases de escape nocivos provienen de vehículos que están empezando a calentarse. Con más motores diseñados para trabajar a temperaturas más bajas, hay una necesidad urgente de identificar nuevos catalizadores que funcionen mejor a esas temperaturas, así como en barcos y camiones que es poco probable que cambien a funcionamiento eléctrico en el futuro próximo.
Pero, ¿qué es lo que hace que un catalizador sea más activo que otro? La respuesta ha sido esquiva.
En este estudio, el equipo de investigación examinó las nanopartículas catalizadoras hechas de platino y paladio desde dos perspectivas -teoría y experimento- para ver si podían identificar estructuras atómicas específicas en su superficie que contribuyeran a una mayor actividad.
Las partículas redondas con bordes dentados
En cuanto a la teoría, el científico de SLAC Frank Abild-Pedersen y su grupo de investigación en el Centro SUNCAT para la Ciencia de la Interfaz y la Catálisis crearon un nuevo enfoque para modelar cómo la exposición a los gases y al vapor durante las reacciones químicas afecta la forma y la estructura atómica de una nanopartícula catalítica. Esto es computacionalmente muy difícil, dijo Abild-Pedersen, y estudios anteriores habían asumido que las partículas existían en el vacío y nunca cambiaban.
Su grupo creó nuevas y más simples formas de modelar partículas en un ambiente más complejo y realista. Los cálculos de los investigadores postdoctorales Tej Choksi y Verena Streibel sugirieron que a medida que las reacciones avanzan, las nanopartículas de ocho lados se vuelven más redondas, y sus superficies planas y con facetas se convierten en una serie de pequeños pasos irregulares.
Al crear y probar nanopartículas de diferentes tamaños, cada una con una proporción diferente de bordes dentados en relación con las superficies planas, el equipo esperaba encontrar exactamente qué configuración estructural, e incluso qué átomos, contribuían más a la actividad catalítica de las partículas.
Un poco de ayuda del agua
Angel Yang, un estudiante de doctorado del grupo de Cargnello, hizo nanopartículas de tamaños controlados con precisión que contenían cada una una mezcla distribuida uniformemente de átomos de paladio y platino. Para ello, tuvo que desarrollar un nuevo método para fabricar las partículas más grandes sembrándolas alrededor de las más pequeñas. Yang utilizó rayos X de la Fuente de Radiación Sincrotrónica de Stanford de SLAC para confirmar la composición de las nanopartículas que hizo con la ayuda de Simon Bare de SLAC y su equipo.
Luego Yang realizó experimentos en los que se utilizaron nanopartículas de diferentes tamaños para catalizar una reacción que convierte el propeno, uno de los hidrocarburos más comunes presentes en los gases de escape, en dióxido de carbono y agua.
"El agua aquí jugó un papel particularmente interesante y beneficioso", dijo. "Normalmente envenena o desactiva los catalizadores. Pero aquí la exposición al agua hizo que las partículas se redondearan y abrieran sitios más activos".
Los resultados confirmaron que las partículas más grandes eran más activas y que se volvían más redondas y más dentadas durante las reacciones, como predijeron los estudios computacionales. Las partículas más activas contenían la mayor proporción de una configuración atómica particular, una en la que dos átomos, cada uno rodeado por siete átomos vecinos, forman pares para llevar a cabo los pasos de la reacción. Fueron estos "7-7 pares" los que permitieron que las partículas grandes se desempeñaran mejor que las pequeñas.
En el futuro, dijo Yang, espera descubrir cómo sembrar nanopartículas con materiales mucho más baratos para reducir su costo y disminuir el uso de metales preciosos raros.
Interés de la industria
La investigación fue financiada por la Corporación BASF a través de la Alianza de Investigación de California, que coordina la investigación entre los científicos de BASF y siete universidades de la costa oeste, incluida la de Stanford.
"Este trabajo aborda cuestiones fundamentales sobre los sitios activos, con la teoría y las perspectivas experimentales unidas de una manera muy agradable para explicar los fenómenos experimentales. Esto nunca se ha hecho antes, y por eso es bastante significativo", dijo Yuejin Li, un científico principal de BASF que participó en el estudio.
"Al final", dijo, "queremos tener un modelo teórico que pueda predecir qué metal o combinación de metales tendrá una actividad aún mejor que nuestro actual estado del arte".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.