Bodas de oro para las moléculas
Oportunidades para una "nueva" química
Las síntesis químicas en líquidos y gases tienen lugar en un espacio tridimensional. Las colisiones aleatorias entre moléculas tienen que dar lugar a algo nuevo en un tiempo extremadamente corto. Pero hay otra manera: en una superficie de oro, en condiciones de ultravacío, se puede hacer que las moléculas que están quietas unas junto a otras se combinen, incluso las que nunca querrían reaccionar entre sí en un líquido. Los investigadores del Empa han descubierto ahora una reacción de este tipo. Lo mejor de todo es que los expertos pueden "tomar fotos" y observar cada paso de la reacción.

Representación artística de la 3+3-cicloadición descubierta en el laboratorio "nanotech@surfaces" de Empa.
Empa
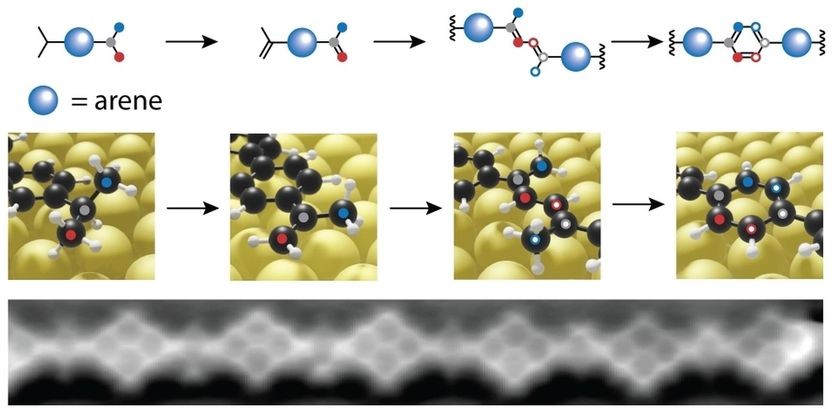
Síntesis química en una superficie de oro: se abstrae un hidrógeno de grupos isopropílicos saturados. Los átomos de carbono (rojo y azul en la imagen superior) se combinan para formar un nuevo anillo de benceno. Se forma una cadena polimérica, visible en un microscopio de fuerza atómica.
Empa

En química, hay estructuras especialmente estables, como el llamado "anillo de benceno", formado por seis átomos de carbono interconectados. Estos anillos son la base estructural del grafito y el grafeno, pero también están presentes en muchos tintes, como el índigo de los vaqueros, y en muchos medicamentos, como la aspirina.
Cuando los químicos han querido construir estos anillos de forma selectiva, han utilizado las llamadas reacciones de acoplamiento, que suelen llevar el nombre de sus inventores: por ejemplo, la reacción de Diels-Alder, la reacción de Ullmann, la ciclización de Bergman o el acoplamiento de Suzuki. Ahora hay otra que aún no tiene nombre. La descubrió un equipo de Empa junto con el Instituto Max Planck de Investigación de Polímeros de Maguncia.
Todo en seco
Los investigadores de Empa omitieron los líquidos en su síntesis química y, en su lugar, fijaron los materiales de partida a una superficie de oro en un vacío ultra alto. El material de partida (diisopropil-p-terfenilo) puede observarse descansando tranquilamente en el microscopio de efecto túnel de barrido enfriado antes de que los investigadores aumenten el calor.
Subir la calefacción: movimiento en la pista de baile
A temperatura ambiente, aún no ocurre nada, pero a unos 200 grados Celsius, se produce una reacción sorprendente que nunca ocurriría en los líquidos: los dos grupos isopropilo -que normalmente son completamente inactivos desde el punto de vista químico- se combinan para formar un anillo de benceno. La razón: debido a la firme "adhesión" a la superficie del oro, primero se suelta un átomo de hidrógeno y luego se libera de la molécula. Así se crean radicales de carbono que esperan nuevos socios. Y hay muchos compañeros en la superficie del oro. A 200 grados Celsius, las moléculas vibran y realizan rápidas piruetas: hay mucho movimiento en la pista de baile dorada. Así que lo que debe estar junto, pronto se junta.
Y de nuevo todo a cámara lenta
El emparejamiento en la superficie dorada tiene dos ventajas. En primer lugar, no hay necesidad de coacción: la reacción tiene lugar sin ácidos bóricos mediadores ni átomos de halógeno que salgan volando. Se trata de un acoplamiento en el que sólo intervienen hidrocarburos saturados. Los materiales de partida son baratos y fáciles de obtener, y no hay subproductos tóxicos.
La segunda ventaja es que los investigadores pueden observar cada paso de la reacción, algo que no es posible con la química clásica "líquida". El equipo de Empa simplemente aumenta el calentamiento de la superficie de oro de forma gradual. A 180 grados Celsius, las moléculas sólo han unido un brazo con sus vecinas, el segundo aún sobresale libremente en la pista de baile. Si ahora se enfría la superficie de oro dentro de un microscopio de barrido de túneles, se pueden ver y "fotografiar" las moléculas justo antes de que se "casen". Esto es exactamente lo que hicieron los investigadores. Así, se puede seguir el mecanismo de reacción en forma de "instantáneas".
Oportunidades para una "nueva" química
Los investigadores y sus colegas esperan que del trabajo actual surjan dos tipos de efectos. En primer lugar, el "método de las instantáneas" podría servir también para dilucidar mecanismos de reacción completamente diferentes. En el Empa se están desarrollando instrumentos que utilizan pulsos láser ultracortos en un microscopio de barrido en túnel para dilucidar tales reacciones químicas paso a paso. Esto podría aportar nuevos conocimientos sobre las reacciones químicas y hacer tambalearse pronto muchas viejas teorías.
Sin embargo, los resultados de la investigación "en seco" también podrían ser útiles para seguir desarrollando la química "líquida". Hasta ahora, la mayoría de las reacciones documentadas en la literatura proceden de la química líquida clásica, y los investigadores de la sonda de barrido han podido recrear estos experimentos. En el futuro, algunas reacciones podrían diseñarse también en el microscopio de barrido en túnel y trasladarse posteriormente a la química líquida o gaseosa.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.



















































