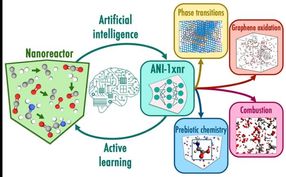
Gilead recibe cartas de respuesta completas de la Agencia de Alimentos y Fármacos (FDA) de Estados Unidos para elvitegravir y cobicistat
Gilead Sciences, Inc. ha anunciado que la empresa ha recibido cartas de respuesta completas de la Agencia de Alimentos y Fármacos (FDA en sus siglas en inglés) de Estados Unidos para sus solicitudes de nuevos fármacos (NDAs en sus siglas en inglés) para elvitegravir y cobicistat para su uso como parte de regímenes de tratamiento del VIH.
En sus comunicaciones, la FDA establece que no puede aprobar las solicitudes en sus formas actuales. Las cartas afirman que durante inspecciones recientes, se han observado varias deficiencias en la documentación y validación de varios procedimientos y métodos de prueba de calidad. Gilead está trabajando con la FDA para hacer frente a las cuestiones surgidas en las cartas de respuesta y hacer avanzar las solicitudes.
Elvitegravir y cobicistat son también componentes del régimen HIV-1 de única pastilla diaria, Stribild® (elvitegravir 150 mg/cobicistat 150 mg/emtricitabina 200 mg/fumarato de tenofovir disoproxil 300 mg) de de Gilead, que fue aprobado por la FDA en agosto para adultos no tratados con anterioridad. Esta acción normativa no afecta a la autorización para la comercialización o el uso continuado de Stribild.
Gilead presentó sus NDAs para elvitegravir y cobicistat en junio de 2012. Las solicitudes para su comercialización también están pendientes en Europa.
Noticias más leídas
Más noticias del departamento investigación y desarrollo

Reciba la química en su bandeja de entrada
No se pierda nada a partir de ahora: Nuestro boletín electrónico de química, análisis, laboratorio y tecnología de procesos le pone al día todos los martes y jueves. Las últimas noticias del sector, los productos más destacados y las innovaciones, de forma compacta y fácil de entender en su bandeja de entrada. Investigado por nosotros para que usted no tenga que hacerlo.