El estudio de la abedulita ofrece información sobre la electroquímica y el almacenamiento de energía
La adsorción de iones del electrolito en la superficie de un electrodo es un proceso omnipresente, de utilidad tanto para las tecnologías de energía electroquímica existentes como para las emergentes. Pero, ¿qué ocurre cuando estos iones penetran en espacios muy pequeños? Para responder a esta pregunta, los investigadores de NC State reexaminaron el comportamiento de un material "clásico", la birnesita.
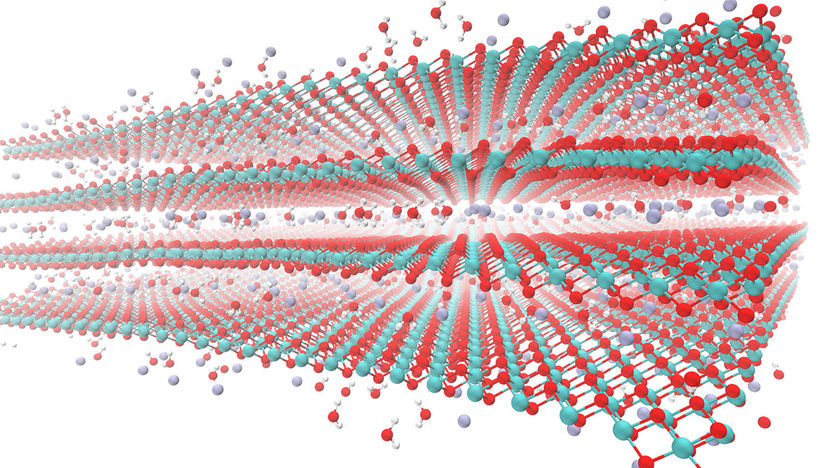
Esta imagen muestra el material birnessita con moléculas de agua (oxígeno rojo, dos hidrógenos blancos) y cationes de potasio (azul oscuro/lavanda) en las superficies exteriores y dentro de la capa intermedia.
Karthik Ganeshan
La birnessita es una forma hidratada de óxido de manganeso en capas que puede almacenar y liberar rápidamente una variedad de iones positivos de los electrolitos durante muchos ciclos. Esto hace que sea prometedor para su uso en el almacenamiento de energía electroquímica de alta potencia, o en tecnologías electroquímicas emergentes como la desalinización y la recuperación de elementos raros del agua. Además, es un material abundante, fácil de fabricar y no tóxico.
El mecanismo por el que la birnesita puede captar y liberar cationes se ha descrito como faradáico (que implica la transferencia de carga) y no faradáico (que implica sólo la adsorción electrostática de iones).
Para abordar este debate, los investigadores utilizaron enfoques experimentales y computacionales.
"En la comunidad de almacenamiento de energía, normalmente pensamos en el almacenamiento de carga como algo faradáico o no faradáico", dice Shelby Boyd, primer autor de un artículo sobre el trabajo e investigador postdoctoral en la Universidad Estatal de Carolina del Norte. "En las interfaces planas, la faradaica se refiere a la adsorción específica de un ion a un electrodo con la correspondiente transferencia de carga, como en una reacción redox. El término "no faradaico" se refiere a la adsorción puramente electrostática sin transferencia de carga. La gente ha presentado estos mecanismos de almacenamiento de carga como mutuamente excluyentes. Pero lo que descubrimos con la birnessita es que el agua estructural intercalada nanoconfinada mitiga las interacciones entre el catión intercalado y la birnessita. Esto da lugar a un comportamiento intermedio entre los dos tipos de extremos de adsorción en las interfaces planas".
Los investigadores también pudieron demostrar experimental y teóricamente que el agua entre las capas de birnessita sirve efectivamente como un amortiguador que hace posible el comportamiento capacitivo sin causar un cambio estructural significativo en la birnessita.
Por último, los investigadores afirman que los hallazgos ponen de relieve dos direcciones futuras para el trabajo, ambas prometedoras para el campo más amplio de la electroquímica.
"El campo de la electroquímica está experimentando un renacimiento", dice Veronica Augustyn, autora del artículo y profesora adjunta de ciencia e ingeniería de materiales en NC State. "La capacidad de conectar los resultados experimentales con el modelado a escala atomística de la interfaz electroquímica nos permite profundizar más que nunca y plantear preguntas como: ¿Qué papel desempeña el disolvente? ¿Qué puede ocurrir cuando la reacción se produce bajo confinamiento? Al comprender el mecanismo capacitivo de un material como la birnesita, sentamos las bases para entender reacciones electroquímicas más complejas".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.